
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Спектральные методы анализа
|
|
Современные методы исследования биологически активных веществ
Практикум
1-е издание
Киров
ДК 658.52 (07)
К897
Допущено к изданию методическим советом биологического факультета ФГБОУ ВПО «ВятГУ» в качестве практикума по выполнению лабораторных работ для студентов направлений 240700 «Биотехнология» всех профилей подготовки, всех форм обучения
Рецензент
доцент кафедры биотехнологии ФГБОУ ВПО «ВятГУ»,
кандидат технических наук
М.Н. Томчук
УДК 658.52 (07)
Учебно-методическое пособие предназначено для студентов направления для студентов направлений 240700 «Биотехнология» всех профилей подготовки, всех форм обучения для выполнения лабораторных работ по дисциплине «Современные методы исследования биологически активных».
Редактор Е.В. Кайгородцева
© ФГБОУ ВПО «ВятГУ», 2014
Демина Л.Л
Современные методы исследования биологически активных веществ
Практикум
1-е издание
Подписано в печать 19.11.12. Печать цифровая. Бумага для офисной техники.
Усл. печ. л. 3, 68. Тираж 156. Заказ № 1183.
Федеральное государственное бюджетное образовательное учреждение высшего про-
фессионального образования «Вятский государственный университет»
610000, г. Киров, ул. Московская, 36, тел.: (8332) 64-23-56, https://vyatsu.ru
Оглавление
1. Общие положения........................................................................................ 4
1.1 Спектральные методы анализа.............................................................. 4
1.2 Высокоэффективная жидкостная хроматография............................. 11
1.2.1 Преимущества метода................................................................... 11
1.2.2 Основной принцип хроматографического разделения............... 14
1.2.3 Устройство жидкостного хроматографа...................................... 17
1.2.3.1 Насосы..................................................................................... 17
1.2.3.2 Устройство для формирования градиента............................ 18
1.2.3.3 Инжекторы.............................................................................. 19
1.2.3.4 Детекторы для ВЭЖХ........................................................... 20
1.2.3.5 Сосуды для подвижной фазы................................................. 23
1.2.3.6 Колонки.................................................................................. 23
2 Методики выполнения лабораторных работ........................................... 25
2.1 Спектрофотометрическое определение витамина В6 (пиридоксина гидрохлорида) 5% в инъекционных препаратах................................................................. 25
2.2 Метод РН дифференциальной спектрофотометрии определения массовой доли суммы антоцианинов в соковой продукции................................................. 28
2.3 Спектрофотометрическое определение количественного содержания аскорбиновой кислоты (витамина С) в напитках................................................................ 34
2.4 Определение содержания витаминов В1, В2 методом ВЭЖХ в премиксах. 38
2.5 Определение содержания и состава углеводов с помощью метода ВЭЖХ. 44
2.5.1 Основы ионообменного метода.................................................... 44
2.5.2 Выбор подвижной фазы и условий разделения........................... 48
2.5.3 Проведение испытания.................................................................. 50
3. Список рекомендуемой литературы......................................................... 54
Общие положения
Спектральные методы анализа
Фотометрические методы анализа основаны на избирательном поглощении электромагнитного излучения анализируемым веществом и служат для исследования строения, идентификации и количественного анализа светопоглощающих соединений. В зависимости от используемой аппаратуры в фотометричеcком анализе различают спектрофотометрические методы — анализ по поглощению веществами монохроматического излучения; колориметрические и фотоколориметрические — анализ по поглощению веществами немонохроматического излучения.
Если анализируемое вещество не поглощает свет в видимой области, иногда его можно химическим путем превращать в окрашенный продукт; в таком случае для анализа используют цветные фильтры, которые поглощают свет на всех длинах волн, за исключением определенного узкого диапазона, называемого шириной полосы пропускания. На использовании цветных фильтров и окрашенных продуктов основаны колориметрические методы анализа. Точность таких методов не очень велика, поскольку даже самые лучшие фильтры (интерференционного типа) имеют недостаточно узкую полосу пропускания.
Если для выбора длины волны используют призмы или решетки, метод анализа называют спектрометрией.
Спектрофотометрия используется для идентификации соединений, исследования состава, строения и количественного анализа индивидуальных веществ и многокомпонентных систем. Кривая зависимости поглощения (функция поглощения) от длины волны или волнового числа называется спектром поглощения вещества и является специфической характеристикой данного вещества.
В спектрофотометрических методах применяют спектрофотометры — приборы, позволяющие проводить анализ как окрашенных, так и бесцветных соединений по избирательному поглощению монохроматического излучения в видимой, ультрафиолетовой и инфракрасной областях спектра. Природа полос поглощения в ультрафиолетовой и видимой области спектра связана с различными электронными переходами в поглощающих молекулах и ионах (электронные спектры).
Распространенная в настоящее время аппаратура позволяет измерять ультрафиолетовые спектры в области от 190 до 380 нм, видимые — от 380 до 780 нм.
Спектрофотометрические измерения в ультрафиолетовой и видимой областях чаще всего проводят для растворов, хотя такие измерения могут быть проведены и для веществ, находящихся в парообразном, жидком и твердом состоянии.
Образец анализируемого вещества при спектрофотометрических определениях обычно растворяют в соответствующем растворителе. Для этих областей пригодны многие растворители, в том числе вода, спирты, хлороформ, низшие углеводороды, эфиры, разведенные растворы аммиака, едкого натра, хлористоводородной или серной кислоты. Следует использовать растворители, не содержащие примесей, поглощающих в данной спектральной области; для спектрофотометрии выпускаются специальные растворители, гарантирующие отсутствие примесей.
Спектрофотометрический анализ по непосредственному измерению оптической плотности может быть проведен для веществ, обладающих лишь определенными особенностями строения (ароматические соединения, соединения с сопряженными кратными связями, соединения ряда металлов и др.).
Некоторые анализируемые вещества необходимо предварительно перевести в соединение, поглощающее излучение.
Для определения концентрации растворов спектрофотометрическим путем используется закон Бугера — Ламберта — Бера в форме:
С= 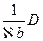 ; (1)
; (1)
где, – 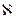 - показатель поглощения раствора, концентрация которого ровна единице;
- показатель поглощения раствора, концентрация которого ровна единице;
b - толщина слоя вещества в сантиметрах;
D - оптическая плотность;
Величина 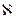 является специфической физической константой для каждого вещества и может быть использована для целей идентификации. Знание величины
является специфической физической константой для каждого вещества и может быть использована для целей идентификации. Знание величины 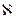 позволяет определить содержание данного вещества в растворах неизвестной концентрации на основе измерения оптической плотности D.
позволяет определить содержание данного вещества в растворах неизвестной концентрации на основе измерения оптической плотности D.
Показатель поглощения 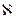 вычисляют на основании измеренной оптической плотности D для растворов с известной концентрацией по формуле:
вычисляют на основании измеренной оптической плотности D для растворов с известной концентрацией по формуле:
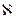 =
= 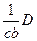 ; (2)
; (2)
Концентрация может быть выражена в молях на литр или в граммах на 100 мл раствора. В зависимости от этого по формуле (2) вычисляют молярный показатель поглощения или удельный показатель поглощения.
Молярный показатель поглощения (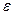 ) представляет собой оптическую плотность одномолярного раствора вещества при толщине слоя 10 мм; удельный показатель поглощения (E1%1cm) – оптическая плотность раствора, содержащего 1 г вещества в 100 мл раствора при той же толщине слоя.
) представляет собой оптическую плотность одномолярного раствора вещества при толщине слоя 10 мм; удельный показатель поглощения (E1%1cm) – оптическая плотность раствора, содержащего 1 г вещества в 100 мл раствора при той же толщине слоя.
Удельный показатель поглощения и молярный показатель поглощения связаны между собой следующим уравнением:
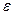 = E1%1cm ∙
= E1%1cm ∙ 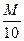 (3)
(3)
Где М – молекулярная масса.
Если известно значение 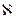 (в форме
(в форме 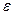 или E1%1cm), определяют концентрацию исследуемых растворов по величине оптической плотности D, пользуясь формулой (1) (при условии подчинения закону Бера).
или E1%1cm), определяют концентрацию исследуемых растворов по величине оптической плотности D, пользуясь формулой (1) (при условии подчинения закону Бера).
В ряде случаев даже при использовании монохроматического излучения могут наблюдаться отклонения от закона Бугера — Ламберта — Бера, обусловленные процессами диссоциации, ассоциации и комплексообразования. При наличии таких отклонений следует пользоваться не формулой, а экспериментально найденной зависимостью оптической плотности от концентрации.
Как в калориметрическом, так и в спектрометрическом анализе обычно готовят серию стандартных растворов, с помощью которых строят градуировочную кривую зависимости поглощения от концентрации; такая градуировочная кривая линейна (соответствует уравнению Бугера-Ламберта-Бера). Затем измеряют поглощение анализируемого раствора и его концентрацию находят по градуировочной кривой по интерполяции. Интерполяция необходима по следующим причинам:
● никогда нельзя экстраполировать результаты за пределы того диапазона, для которого имеется градуировочная кривая;
● особенно при проведении колориметрического анализа определенную роль может иметь так называемый «эффект Иова».
Если продолжать проводить измерения за пределами, установленными для окрашенного реагента, выясняется, что линейность графика уравнения Бугера–Ламберта–Бера нарушается; график выходит на плато в той точке, когда количество реагента не достаточно для дальнейшего развития окраски. Данное явление известно как «эффект Иова». Следовательно, экстраполяция градуировочной кривой может привести к очень большой ошибке.
Если не требуется высокой точности измерений, а анализируемое вещество и стандарт имеют близкие значения поглощения, можно воспользоваться линейностью уравнения Бугера–Ламберта–Бера и найти приблизительную концентрацию образца из соотношения:
Концентрация = 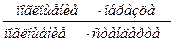
Разумеется, такое приближение приемлемо лишь в том случае, если соотношение Бугера–Ламберта–Бера для конкретной задачи было установлено в предварительном эксперименте.
Измерения оптической плотности D в ультрафиолетовой и видимой области проводятся на фотоэлектрических спектрофотометрах. Основными частями этих приборов являются:
● источник излучения (лампа накаливания c вольфрамовой спиралью производит свет в видимой части спектра, газоразрядная водородная или дейтериевая лампа излучает в ультрафиолетовой области):
● в спектрофотометрах ширина полосы определяется монохроматором, диспергирующая система которого основана на использовании кварцевой призмы или дифракционной решетки. Разрешение длин волн на решетках выше, чем на призмах:
● кюветное отделение, в котором располагаются кюветы с исследуемыми веществами. Кюветы должны быть пригодны для точного анализа, иметь параллельные поверхности и одинаковые длины светового пути:
● приемное и фотометрическое устройство для сравнительной оценки интенсивности световых потоков Ј0 и Ј, основанное на использовании фотоэлементов.
На рисунке 1.1 изображена схема однолучевого прибора.
Измерительная шкала спектрофотометра проградуирована в процентах пропускания Т (т.е. 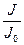 ∙ 100) и в величинах оптической плотности D (т.е. lg
∙ 100) и в величинах оптической плотности D (т.е. lg 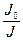 ), а шкала длин волн или волновых чисел — в нанометрах или в см-1 соответственно.
), а шкала длин волн или волновых чисел — в нанометрах или в см-1 соответственно.
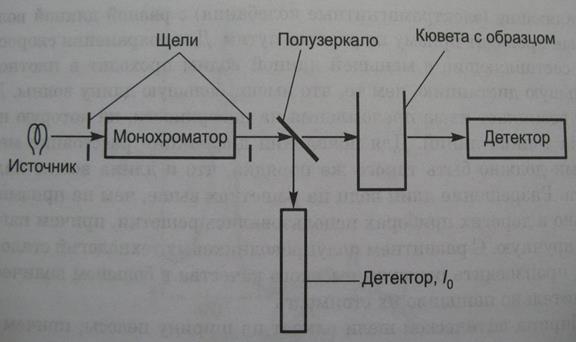
Рис.1.1.1 Схема однолучевого спектрофотометра
В процессе измерения на пути выходящего из монохроматора пучка излучения определенной длины волны поочередно устанавливается нулевой раствор (растворитель или раствор, содержащий те же вещества, что и исследуемый, за исключением анализируемого компонента), для которого T = 100%, D = 0и исследуемый раствор.
Для снижения величины ошибки при определении D концентрация раствора и толщина слоя его подбираются такими, чтобы D в исследуемой спектральной области находилось в пределах от 0, 2 до 0, 7. В зависимости от способности вещества к поглощению это обычно достигается при использовании концентраций от 0, 01 до 0, 00001% (кюветы с толщиной слоя 10 мм).
Однако главным достоинством спектрофотометра является возможность сканировать полный диапазон длин волн в УФ и видимой области и получать спектры поглощения. Эти спектры отражают зависимость поглощения от длины волны. Спектры поглощения – это результат определенных электронных переходов. Чаще всего это π -электроны, участвующие в образовании двойных связей углерод-углерод, а также электроны неподеленных электронных пар азота и кислорода. Длина волны поглощаемого света определяется соответствующими электронными переходами, поэтому специфические пики поглощения можно связать с известными молекулярными фрагментами.
Термин хромофор применяют для обозначения отдельной группы, которая имеет характерный спектр поглощения. Сопряжение двойных связей приводит к снижению энергии (частоты), необходимой для осуществления электронных переходов, и, следовательно, приводит к увеличению длины волны, при которой поглощает хромофор. Данное явление называется батохромным сдвигом. Например, протонирование азота в ароматическом кольце, при котором происходит снижение степени сопряжения, вызывает гипсохромный сдвиг в сторону коротких длин волн. Гиперхромный эффект соответствует увеличению высоты пика, а гипохромный – ее уменьшению.
|
|