
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Основные теоретические сведения
|
|
Лабораторная работа 3
СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Цель работы – изучение зависимости скорости химической реакции от концентрации реагирующих веществ и температуры; исследование смещения химического равновесия.
Основные теоретические сведения
Скорость реакции – это изменение количества реагирующего (исходного) вещества или получающихся веществ (продуктов) в единицу времени в единице реакционного пространства. В гомогенных реакциях таким пространством является объем реакционного сосуда, в гетерогенных – поверхность раздела, на которой протекает реакция. Средняя скорость 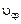 (моль/л× с) выражается формулой
(моль/л× с) выражается формулой
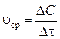 , (1)
, (1)
где Δ С = С к – С н – изменение концентрации реагирующего вещества, моль/л; С к и С н– конечная и начальная концентрации, соответственно; Δ τ – промежуток времени, с.
Скорость химических реакций зависит от следующих факторов: природы реагирующих веществ, их концентрации, температуры, присутствия катализаторов.
Влияние концентрации реагирующих веществ на скорость реакции впервые установил в 1865 г.Н. Н. Бекетов. Позднее, в 1867 г., норвежские ученые Гульдберг и Вааге сформулировали это положение в более общей форме, получившей название закона действующих масс (з.д.м.): при постоянной температуре скорость химической реакции пропорциональна произведению концентраций реагирующих веществ, возведенных в степени, равные их стехиометрическим коэффициентам.
Влияние температуры на скорость реакции устанавливает правило Вант-Гоффа: повышение температуры на каждые 10° С увеличивает скорость реакции примерно в 2–4 раза. Это объясняется тем, что сповышением температуры увеличивается доля активных молекул в системе, а следовательно, увеличивается и число столкновений активных молекул в единицу времени, приводящее к образованию продуктов реакции.
Математически зависимость скорости реакции от температуры выражается уравнением
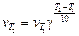 ,
,
где 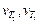 – скорости реакции при конечной Т 2 и начальной Т 1 температурах; γ – температурный коэффициент скорости реакции; Т 2 – Т 1 – разность конечной и начальной температур.
– скорости реакции при конечной Т 2 и начальной Т 1 температурах; γ – температурный коэффициент скорости реакции; Т 2 – Т 1 – разность конечной и начальной температур.
Все химические реакции можно разделить на необратимые, которые протекают до конца, и обратимые. Обратимые реакции протекают в двух противоположных направлениях – прямой и обратной. Когда скорость прямой реакции становится равной скорости обратной реакции, наступает состояние химического равновесия, характеризующееся константой равновесия К. Для гомогенной реакции
mA + nB ⇄ pC + gD
выражение константы химического равновесия K имеет вид
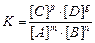 ,
,
где[ A ]; [ B ]; [ C ]; [ D ] – равновесные концентрации веществ А, В, С, D; m, n, p, g – стехиометрические коэффициенты.
Для гетерогенных реакций в выражение константы равновесия не входят концентрации твердых фаз.
Химическое равновесие подвижно, динамично. Внешним воздействием на равновесную систему можно изменять ее состояние, т. е. сместить равновесие либо в сторону прямой, либо в сторону обратной реакции. Правило, позволяющее предвидеть направление смещения равновесия, называется принципом Ле-Шателье: если на систему, находящуюся в равновесии, оказать какое-либо воздействие (изменить концентрацию, давление, температуру), то равновесие смещается в направлении той реакции, которая противодействует произведенному воздействию.
Так, уменьшение концентрации одного из веществ вызовет смещение равновесия в сторону образования этого вещества; повышение давления сместит равновесие в сторону реакции, приводящей к образованию меньшего числа газообразных молекул, а уменьшение давления – наоборот; повышение температуры сместит равновесие в сторону эндотермической реакции и наоборот.
|
|