
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Б) NaH PO , (FeOH) SO , Na S
|
|
в) (NaH) 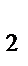 PO
PO  , Fe(OH)
, Fe(OH) 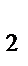 SO
SO  , Na
, Na 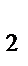 SO
SO 
г) NaH 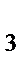 PO
PO  , (Fe)(OH)SO
, (Fe)(OH)SO  , Na
, Na 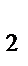 S
S
д) NaH 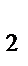 PO
PO 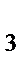 , Fe(OH)
, Fe(OH) 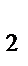 SO
SO  , Na
, Na 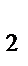 SO
SO 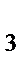
268. Масса образца карбоната кальция равна 10 г. Определите количество моль этой соли:
а) 100
б) 0, 01
В) 0, 1
г) 10
д) 0, 5
269. Относительная плотность газообразного оксида азота по водороду равна 15. Определите молярную массу оксида (г/моль):
А) 30
б) 44
в) 46
г) 26
д) 58
270. Относительная плотность газа по кислороду равна 2. Какова его плотность по водороду?
А) 32
б) 16
в) 64
г) 40
д) 36
271. Сколько молекул серы содержится в октасере S 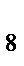 массой 2, 56 г?
массой 2, 56 г?
а) 6, 02·1023
б) 6, 02·1021
в) 256
г) 200
д) 6, 02·10-23
272. Какую массу (г) имеют 1, 55·10 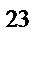 молекул Н
молекул Н 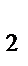 О?
О?
А) 4, 63
в) 0, 353
б) 18
г) 9, 473
д) 72
273. Определите фактор эквивалентности перманганата калия и сероводорода в окислительно-восстановительной реакции
KMnO 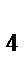 + H
+ H 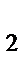 S + H
S + H 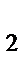 SO
SO 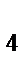 = MnSO
= MnSO 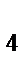 + S + K
+ S + K 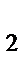 SO
SO 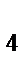 + H
+ H 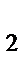 O:
O:
а) 1/5 и 1/2
б) 1 и 1/2
В) 1/2 и 1/5
г) 1 и 1/5
д) 1 и 1
274. Определите значения молярных масс эквивалентов (г/моль) следующих веществ: NaCl и NaНSO 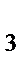 :
:
А) 58, 5 и 104
б) 58, 5 и 52
в) 29, 25 и 104
г) 29, 25 и 52
д) 117 и 104
275. Металл массой 6 г при взаимодействии с кислотой вытеснил водород массой 0, 5 г. Молярная масса эквивалента металла (г/моль) равна:
а) 1, 2
Б) 12
в) 120
г) 10
д) 6
276. Для сгорания металла массой 3, 6 г требуется кислород объемом 2, 24 л (н.у.). Молярная масса эквивалента металла (г/моль) равна:
а) 9
Б) 18
в) 4, 5
г) 27
д) 22, 5
277. На нейтрализацию кислоты массой 3, 65 г израсходовали раствор, содержащий 5, 6 г гидроксида калия. Молярная масса эквивалента кислоты (г/моль-экв.) равна:
а) 365
б) 3, 65
В) 36, 5
г) 0, 365
д) 18, 25
278. Реакция протекает в соответствии с уравнением
2H 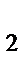 S + 3O
S + 3O 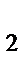 = 2SO
= 2SO 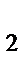 + 2H
+ 2H 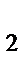 О.
О.
Какой объем (л) диоксида серы (н. у.) образуется при сжигании 20 л H 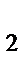 S?
S?
а) 22, 4
в) 44, 8
б) 33, 6
Г) 20
д) 15
279. Сколько граммов 25 % раствора серной кислоты может вступить в реакцию со 160 г гидроксида натрия, если в результате взаимодействия образуется средняя соль?
а) 49
в) 392
б) 1568
Г) 784
д) 196
280. Электронная формула атома 1s 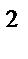 2s
2s 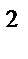 2p
2p 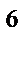 3s
3s 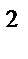 3p
3p 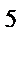 . Высшая степень окисления элемента равна:
. Высшая степень окисления элемента равна:
а) +5
б) +6
в) +7
г) +8
д) +2
281. Укажите полную электронную формулу атома 23V в основном состоянии, располагая орбитали (энергетические подуровни) в соответствии с увеличением энергии. Определите набор четырех квантовых чисел для последнего электрона данного элемента:
а) 1s 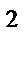 2s
2s 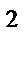 2p
2p 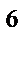 3s
3s 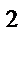 3p
3p 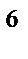 3d
3d 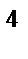 4s
4s 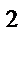 , n = 4, l = 0, ml = 0, ms = –Ѕ
, n = 4, l = 0, ml = 0, ms = –Ѕ
б) 1s 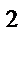 2s
2s 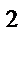 2p
2p 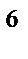 3s
3s 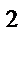 3p
3p 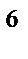 4s
4s 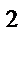 3d
3d 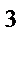 , n = 3, l = 2, ml = 0, ms = Ѕ
, n = 3, l = 2, ml = 0, ms = Ѕ
в) 1s 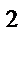 2s
2s 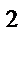 2p
2p 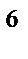 3s
3s 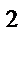 3p
3p 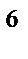 3d44s
3d44s 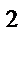 , n = 3, l = 2, ml = 1, ms = Ѕ
, n = 3, l = 2, ml = 1, ms = Ѕ
г) 1s 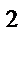 2s
2s 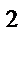 2p
2p 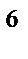 3s
3s 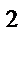 3p
3p 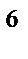 4s
4s 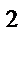 3d
3d 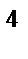 , n = 3, l = 2, ml= –1, ms= –Ѕ
, n = 3, l = 2, ml= –1, ms= –Ѕ
д) 1s 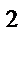 2s
2s 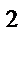 2p
2p 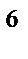 3s
3s 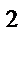 3p
3p 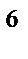 4s
4s 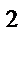 3d
3d 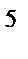 , n = 3, l = 1, ml= –1, ms= –Ѕ
, n = 3, l = 1, ml= –1, ms= –Ѕ
282. Расположите следующие орбитали (энергетические подуровни) в порядке возрастания энергии: 4p, 4s, 4d, 5s, 5p. Использование какого правила позволяет подтвердить данную последовательность?
а) 4s< 4p< 4d< 5s< 5p, 1-е правило Клечковского
б) 4s < 4p< 5s< 4d< 5p, 1-е правило Клечковского
в) 4s< 4p< 4d< 5s< 5p, 1-е и 2-е правила Клечковского
|
|