
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Сфера застосування
|
|
Цей документ встановлює фотоколориметричну методику виконання вимірювання масової концентрації нітрату амонію в азотній кислоті в трубопроводі із продувної колони в діапазоні вимірювання від 12, 0 мг/дм3 до 90, 0 мг/дм3.
Ця методика поширюється на ВАТ “Рівнеазот” в цеху неконцентрованої азотної кислоти і застосовується поза сферою поширення державного метрологічного нагляду.
Час виконання вимірювання 30 хвилин.
Метод вимірювання
Вимірювання масової концентрації нітрату амонію в азотній кислоті виконують фотоколориметричним методом, який заснований на вимірюванні оптичної густини забарвлених в жовтий колір розчинів, які містять комплексні сполуки, утворені при взаємодії іонів амонію з реактивом Неслера.
Підготовка до виконання вимірювання
При підготовці до виконання вимірювання виконують наступні роботи:
1 Підготовка приладу до роботи
Колориметр фотоелектричний концентраційний КФК-2 включають згідно з інструкцією до приладу [5]. Час виходу приладу на робочий режим 30 хвилин. Вимірювання виконують при довжині хвилі λ =400 нм.
2 Відбір проби
Пробу азотної кислоти відбирають в місцях, які призначені для пробовідбору в чисту склянку з товстостінного скла з притертою пробкою. Перед відбором склянку ополіскують азотною кислотою, яку відбирають. На склянці роблять надпис з зазначенням назви проби, дати, часу та місця відбору.
3 Приготування безаміачної дистильованої води
Збирають установку для прямої перегонки під атмосферним тиском, яка складається з круглодонної колби місткістю 1000 см3, насадки, прямого холодильника, алонжа та приймача. Круглодонну колбу на ⅔ заповнюють дистильованою водою, в яку додають 2 – 3 краплі розчину сірчаної кислоти з масовою часткою 98 % та 2 – 3 кристалики калію марганцевокислого. Заповнюють холодильник водою і починають нагрівати колбу. Перші 100 см3 отриманого дистиляту виливають, а потім перевіряють на вміст іону амонію реактивом Неслера, для чого циліндром місткістю 50 см3 відбирають дистилят в об’ємі 10 – 15 см3 і додають 2 – 3 краплі сегнетової солі та 2 – 3 краплі реактиву Неслера. Якщо вода не забарвиться в жовтий колір, то іони амонію відсутні. Таку воду збирають і зберігають в закритому бутлі. Перед кожним вимірюванням воду перевіряють на вміст іону амонію.
4 Приготування основного стандартного розчину з масовою
концентрацією нітрату амонію NH4NO3 0, 47 мг/см3
На вазі, яка вказана в розділі 4, зважують наважку хлористого амонію (попередньо перекристалізованого і висушеного) масою 0, 31410 г, переносять в мірну колбу місткістю 1000 см3, розчиняють у безаміачній воді і доводять об’єм розчину в колбі до риски тією ж водою і ретельно перемішують.
5 Приготування робочого стандартного розчину з масовою
концентрацією нітрату амонію NH4NO3 0, 047 мг/см3
Робочий стандартний розчин з масовою концентрацією нітрату амонію NH4NO3 0, 047 мг/см3 готують розбавленням основного стандартного розчину з масовою концентрацією нітрату амонію NH4NO3 0, 047 мг/см3 в 10 раз безаміачною дистильованою водою. Для цього в мірну колбу місткістю 100 см3 вносять піпеткою місткістю 10 см3 основний стандартний розчин в об’ємі 10 см3, доводять об’єм розчину в колбі до риски дистильованою безаміачною водою і ретельно перемішують. Робочий стандартний розчин готують перед виконанням вимірювання.
6 Побудова градуювального графіка
В мірні колби місткістю 50 см3 послідовно вносять з бюретки місткістю 2 см3 робочий стандартний розчин з масовою концентрацією нітрату амонію NH4NO3 0, 047 мг/см3 в об’ємі 0, 5; 0, 75; 1, 0; 1, 25; 1, 50; 1, 75; 2, 0 см3, що відповідає 0, 0235; 0, 0353; 0, 0470; 0, 0588; 0, 0705; 0, 0823; 0, 0940 мг NH4NO3. Об’єми розчинів в колбах доводять до риски дистильованою безаміачною водою і ретельно перемішують, додають піпеткою місткістю 1 см3 реактив Неслера в об’ємі 1 см3.
Через 10 хвилин вимірюють оптичну густину отриманих розчинів при довжині хвилі λ =400 нм в кюветі з товщиною світлопоглинаючого шару ℓ =50 мм. Як розчин порівняння (“холоста” проба), використовується розчин, який містить внесені з тією ж послідовністю всі вище зазначені реактиви, крім стандартного розчину.
За отриманими даними будують градуювальний графік, відкладаючи на осі абсцис введену масу нітрату амонію NH4NO3 (а) в мг, а на осі ординат відповідні їм значення оптичних густин. Градуювальний графік будують в координатах: а, мг – оптична густина D по середніх значеннях з трьох паралельних вимірювань.
Градуювальний графік перевіряють один раз в 90 днів, а також у випадку заміни реактивів або приладів.
Виконання вимірювання
При виконанні вимірювання масової концентрації нітрату амонію виконують наступні операції:
В мірну колбу місткістю 100 см3 вносять піпеткою місткістю 20 см3 азотну кислоту, що аналізують, в об’ємі 20 см3 і обережно розбавляють її безаміачною дистильованою водою. Об’єм розчину в колбі доводять до риски безаміачною дистильованою водою і ретельно перемішують.
Якщо розчин після розведення безбарвний, виконують пряме вимірювання масової концентрації нітрату амонію. Попередньо розчин нейтралізують. Для цього з мірної колби місткістю 100 см3 відбирають піпеткою відповідної місткості розчин в об’ємі 5 см3 або 10 см3 в залежності від вмісту нітрату амонію в пробі і переносять його в конічну колбу місткістю 250 см3, додають 2 – 3 краплі розчину метилового червоного і титрують вміст колби з бюретки місткістю 25 см3 розчином гідроксиду натрію з молярною концентрацією с(NaOH)=1 моль/дм3 до переходу забарвлення середовища від червоного до жовтого.
Потім піпеткою відповідної місткості з мірної колби місткістю 100 см3 відбирають розчин в об’ємі 5 см3 або 10 см3 і переносять в мірну колбу місткістю 50 см3 і додають з бюретки місткістю 25 см3 розчин гідроксиду натрію з молярною концентрацією с(NaOH)=1 моль/дм3 в об’ємі, який витрачено на нейтралізацію розчину кислоти. Об’єм розчину в мірній колбі доводять до риски безаміачною дистильованою водою, додають піпеткою місткістю 1 см3 реактив Неслера в об’ємі 1 см3 і через десять хвилин вимірюють оптичну густину отриманого розчину при довжині хвилі λ =400 нм в кюветі з товщиною світлопоглинаючого шару ℓ =50 мм. Як розчин порівняння (“холоста” проба) використовують розчин, який готують так як і при побудові градуювального графіка.
За допомогою градуювального графіка згідно з отриманою оптичною густиною знаходять масу нітрату амонію NH4NO3 в пробі, що аналізують.
Якщо забарвлення розчину після додавання реактиву Неслера дуже інтенсивне, то проводять більше розведення розчину.
Якщо розчин після розведення має інтенсивне забарвлення, проводять відгонку аміаку на установці, яка представлена на рис.1. Після відгонки вимірюють вміст аміаку в конденсаті. Для цього піпеткою місткістю 20 см3 вносять азотну кислоту, що аналізують, в об’ємі 20 см3 в перегонну колбу (1) з кипілками і додають циліндром місткістю 100 см3 безаміачну дистильовану воду в об’ємі 100 см3. Колбу щільно закривають пробкою, в яку вставлені крапельна лійка (2) і краплевловлювач (3), приєднують краплевловлювач до холодильника (4).
В приймач (6), в якості якого використовують мірну колбу місткістю 100 см3, наливають циліндром місткістю 50 см3 безаміачну дистильовану воду в об’ємі від 25 см3 до 30 см3. Через крапельну лійку (2) в перегонну колбу (1) наливають циліндром місткістю 50 см3 розчин гідроксиду натрію з масовою часткою 40 % в об’ємі 40 см3. При зливанні розчину гідроксиду натрію в колбу в лійці залишають невеликий об’єм розчину в якості гідрозатвору.
Подають воду в холодильник і нагрівають розчин в колбі на колбонагрівачі до кипіння. Відгонку ведуть до тих пір, доки рівень конденсату в колбі-приймачі (6) не наблизиться до риски.
Після відгонки об’єм розчину в колбі-приймачі доводять до риски безаміачною дистильованою водою, обмиваючи алонж (5). Вміст колби ретельно перемішують. Піпеткою відповідної місткості відбирають з мірної колби місткістю 100 см3 розчин в об’ємі 5 см3 або 10 см3 і переносять в мірну колбу місткістю 50 см3. Об’єм розчину в колбі доводять до риски безаміачною дистильованою водою, ретельно перемішують вміст колби, додають піпеткою місткістю 1 см3 реактив Неслера в об’ємі 1 см3 і через 10 хвилин вимірюють оптичну густину отриманого розчину при довжині хвилі λ =400 нм в кюветі з товщиною світлопоглинаючого шару ℓ =50 мм.
Як розчин порівняння (“холоста” проба) використовують розчин контрольного досліду, який проводять в тих же умовах і з такими ж кількостями реактивів без проби азотної кислоти.
За допомогою градуювального графіка згідно з отриманою оптичною густиною знаходять масу нітрату амонію NH4NO3 в пробі, що аналізують.
Обчислення результатів вимірювання
Обчислення результатів вимірювання масової концентрації нітрату амонію NH4NO3 ρ в мг/дм3 виконують за формулою:
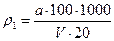 ,
,
де а – маса нітрату амонію NH4NO3 в пробі, яка знайдена за градуювальним графіком, мг;
20 – об’єм проби азотної кислоти, що аналізують, см3;
100 – об’єм колби, в якій проводили розведення, см3;
V – об’єм аліквотної частини розчину, який відібрано для вимірювань, см3;
1000– перерахунок масової концентрації в мг/см3 в масову концентрацію в мг.
4. Метрологія. Кислотний підцикл. Загальна лужність.
|
|