
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Формулы расчета концентраций растворов
|
|
(А – формула растворенного вещества; Растворитель – обычно, H2O)
| НАИМЕНОВАНИЕ, тип концентрации | ФОРМУЛА расчета | числитель | знаменатель | РАЗМЕРНОСТЬ концентрации | ||||||
Массовая ПРОЦЕНТНАЯконцентрация,
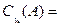
| 
| 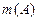
| 
| % | ||||||
Молярная концентрация (МОЛЯРНОСТЬ),

| 
| 
| 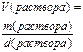
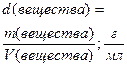
| 
| ||||||
Нормальная концентрация (НОРМАЛЬНОСТЬ),
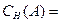

| 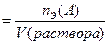
| 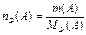
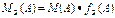

| 
| |||||||
Моляльная концентрация (МОЛЯЛЬНОСТЬ),
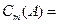
| 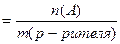
| 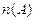
| 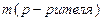
| 
| ||||||
МОЛЯРНАЯ (мольная)ДОЛЯ, 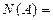
| 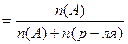
| 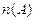
| Сумма числа моль растворенного вещества 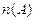 и и 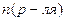
| - | ||||||
ТИТРраствора, 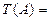
| 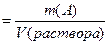
| 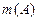
| 
| 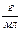
| ||||||
| ФОРМУЛЫ РАСЧЕТА ФАКТОРА ЭКВИВАЛЕНТНОСТИ =fэ(A)*, для разных веществ в обменных реакциях и в ОВР: | ||||||||||
| fэ(A)* | ОБМЕННЫЕ реакции | ОВ- реакции | ||||||||
| ОКСИДЫ | ГИДРОКСИДЫ | КИСЛОТЫ | СОЛИ | 1/+n∙ ē или 1/-m∙ ē | ||||||
| Э2Ох | Ме(ОН)n | НmА | МеmАn | |||||||
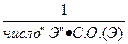
| 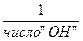
| 
| 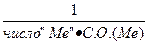
| |||||||
КОЛЛИГАТИВНЫЕ (собирательные) СВОЙСТВА РАСТВОРОВ НЕЭЛЕКТРОЛИТОВ.
В формулах: индекс (0) – обозначает растворитель; (1) - обозначает растворенное вещество (А).
№1. ЗАКОН РАУЛЯ ð относительное понижение давления пара растворителя (0) над раствором: DР/Ро = N(1)
DР = Ро , (растворителя) – Ро , (раствора); (Ро, Н2О293 К = 2, 34 кПа; Ро, Н2О298 К = 3, 17 кПа; Ро, Н2О303 К = 4, 24 кПа)
№2. 1 СЛЕДСТВИЕ ЗАКОНА РАУЛЯ ð Dtзам. = K∙ Сm(1); К(Н2О) = 1, 86о; tзам.(Н2О) = 0 оС;
ПОНИЖЕНИЕ ТЕМПЕРАТУРЫ ЗАМЕРЗАНИЯ РАСТВОРА: Dtзам. = tзам.(0) - tзам.(раствора);
№3. 2 СЛЕДСТВИЕ ЗАКОНА РАУЛЯ ð: Dtкип. = Е∙ Сm(1); Е(Н2О) = 0, 52о; tкип.(Н2О) = 100 оС;
ПОВЫШЕНИЕ ТЕМПЕРАТУРЫ КИПЕНИЯ РАСТВОРА: Dtкип. = tкип.(раствора) - tкип.(0);
№4. ЗАКОН ВАНТ-ГОФФА ð ОСМОТИЧЕСКОЕ ДАВЛЕНИЕ РАСТВОРА: p = R∙ T∙ CM(1); Т = (t+273) К
В растворах ЭЛЕКТРОЛИТОВ растворенное вещество - (А) обязательно подвержено ЭЛЕКТРОЛИ-ТИЧЕСКОЙ ДИССОЦИАЦИИ - (ЭД), при которой из каждой его молекулы образуется еще определенное число ионов, за счет которых ВОЗРАСТАЕТ общее количество растворенных частиц.
КОЛЛИГАТИВНЫЕ СВОЙСТВА в растворах ЭЛЕКТРОЛИТОВ превышают в i -раз свойства, рассчитанные по ТЕОРЕТИЧЕСКИМ ЗАКОНАМ №1, №2, №3, №4, которые не учитывают ионный распад молекул.
i = [ a ∙ (к - 1) + 1] - этот коэффициент ПРИНЯТО НАЗЫВАТЬ изотоническим: он показывает превышение числа частиц в растворе электролита (молекулы + ионы) над изначальным их количеством (молекулы).
к - число ионов, образующихся при распаде ОДНОЙ молекулы; a - степень ЭД растворенного электролита:
a = 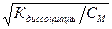 ;
; 
В обобщенном виде: cв-во (№1, №2, №3, №4)электролит = i∙ cв-во (№1, №2, №3, №4)неэлектролит
ЭД (электролитическая диссоциация) – это распад «молекул» на ИОНЫ (n+ или m-) в расплавах веществ или в их растворах с полярными растворителями. По отношению веществ к состоянию ЭД выделяют:
а) НЕЭЛЕКТРОЛИТЫ – «прочны», не образуют положительные и отрицательные части (AmBn ¹ ® …),
б) плохо, «стадийно» распадаются на катионы и на анионы СЛАБЫЕ электролиты: AmBn Û mAn+ + nBm-,
в) – СИЛЬНЫЕ электролиты, хорошо, «полностью» распадаются на ионы: AmBn Þ mAn+ + nBm-.
НЕЭЛЕКТРОЛИТЫ – это: 1). все ОКСИДЫ 2). все ПРОСТЫЕ вещества, …,;
СИЛЬНЫЕ электролиты – это: 1). все ЩЕЛОЧИ – KOH, Ca(OH)2, …
2). КИСЛОТЫ – HCl, HBr, HI, …, ЭО3(ОН)m – HMnO4, HClO3, …, ЭО2(ОН)m – H2SO4, HNO3, …,
3). почти все СОЛИ;
СЛАБЫЕ электролиты (a< 100%) – это: 1). ГИДРОКСИДЫ любых НЕ ЩЕЛОЧНЫХ металлов, Кв< 10-4,
2). слабые КИСЛОТЫ – все за исключением СИЛЬНЫХ кислот, Ка< 10-4.
ЭД ВОДЫ - процесс «неохотный»: 1Н2О Û 1 Н+ + 1 ОН -; КН2О = 1, 8∙ 10-16
уравнение ИП воды: [Н+]∙ [ОН-] = 10-14; логарифмическая форма УИП воды: рН + рОН = 14
рН = -lg[Н+]; рОН = -lg[ОН-]; 0 £ рН £ 14
КИСЛЫЕ (Н+)- среды (рН< 7), НЕЙТРАЛЬНЫЕ (Н2О)- среды (рН = 7), ЩЕЛОЧНЫЕ (ОН -)-среды (рН> 7).
ГИДРОЛИЗ СОЛЕЙ – это разложение ВОДЫ ионами соли, приводящее к нарушению кислотно-щелочной НЕЙТРАЛЬНОСТИ образующегося раствора и возникновению либо рН< 7, либо рН> 7. Реакции соли с водой определяются ее концентрацией (Cs) и ионным составом – участвуют только ионы СЛАБЫХ электролитов:
| СОЛЬ ОБРАЗОВАНА | Кв или Ка | Ион среды | рН | К г = | h = | [иона] среды | |
| Основание | кислота | ||||||
| Сильное | Слабая | Ка< 10-4 | ОН- | рН> 7 | = 
| = 
| [OH-]= 
|
| Слабое | Сильная | Кв< 10-4 | Н+ | рН< 7 | = 
| = 
| [H+]= 
|
| Слабое | Слабая | Кв и Ка< 10-4 | ОН- или Н+ | рН³ 7 | = 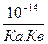
| - | - |
| Сильное | Сильная | КвиКа> 10-4 | - | рН = 7 | НЕТ ГИДРОЛИЗА |
БУФЕРНЫЕ РАСТВОРЫ (смеси) ð а) слаб.кислота+ее соль, б) слаб.основание+его соль, в) «смесь» солей
Уравнения Хассельбаха-Хендерсона: для смесей а) рН = рКа-  , для смесей б) рН = 14-рКв+
, для смесей б) рН = 14-рКв+  .
.
ОВ-реакции – в отличие от простых ОБМЕННЫХ, это реакции, протекающие с изменениями СТЕПЕНЕЙ ОКИСЛЕНИЯ элементов, называемых В-ЛЬ и О-ЛЬ. Электронная теория (Л.В.Писаржевский, 1910 г.):
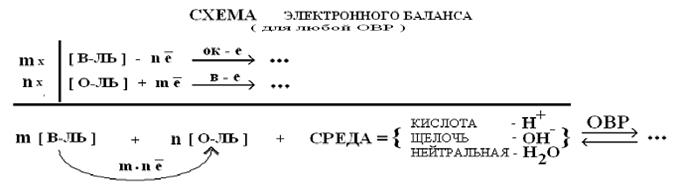
| В-ЛЬ | ОВ-двойственность | О-ЛЬ |
| С.О.- МИНИМАЛЬНАЯ | С.О.- ПРОМЕЖУТОЧНАЯ | С.О.- МАКСИМАЛЬНАЯ |
| ¹ +m∙ ē -n∙ ē ® | +m∙ ē -n∙ ē ® | +m∙ ē -n∙ ē ¹ |
| H- | H20 | H+ |
| O-2 | O-1 | O20, (F2O+1) |
| S-2 | S0, S+4 | S+6 |
| N-3 | N20, N+1, N+2, N+3, N+4 | N+5 |
| K0 | - | K+1 |
| Cr0 | Cr+2, Cr+3 | Cr+6 |
| Mn0 | Mn+2, Mn+3, Mn+4, Mn+6 | Mn+7 |
Типичные В-ЛИ – это в-ва в МИНИМАЛЬНОЙ или невысоких С.О.: Zn, Na2S, CaC2, H2, …
Типичные О-ЛИ – это в-ва в МАКСИМАЛЬНОЙ или высоких С.О.: K2Cr2O7, Na2CO3, KNO3, O2, Hg2Cl2, …
| ПОРЯДОК ПОДБОРА КОЭФФИЦИЕНТОВ в схемах ОВРс использованием МЕТОДОВ: | |
| 1). ЭЛЕКТРОННЫЙ БАЛАНС (применим для реакций в неводных средах) | |
| расставитьС.О.ВСЕМ элементам взаимодействующих веществ | |
| составитьэлектронные уравнениядля процессовО-ЯиВ-Я: (± m∙ n ē) | |
| выполнитьЭЛЕКТРОННЫЙ БАЛАНСи выставитькоэффициенты к ЧЕТЫРЕМ веществам ОВР | |
| выставить вПОСЛЕДНЮЮ очередь коэффициент к молекулам ВОДЫ по балансуН-атомов | |
| проверка ПРАВИЛЬНОСТИ выставленных коэффициентов в ОВР ð по балансу О-атомов | |
| 2). ПОЛУРЕАКЦИИ = ионно-электронный баланс (отражает ЭД-состояние КАЖДОГО вещества в водном растворе и характер среды в реакции) | |
| указать молекулу реагента, определяющую характер СРЕДЫ (выбрать схему добавления О-атомов) | |
| оценить состояние ЭД каждого вещества и «разделить» на части молекулы СИЛЬНЫХ электролитов - (/) | |
| составить уравнения полуреакций для процессов В-Я и О-Я с учетом характера СРЕДЫ и ПОДСКАЗОК | |
| получить ПИУ и КИУ ОВРсложением уравнений полуреакций с учетом множителей электронного баланса (±m n ē) | |
| (!) - проверить правильность КИУ ОВР по равенству ЗАРЯДОВ его левой и правой частей | |
| перенести КОЭФФИЦИЕНТЫ из КИУ ОВР к соответствующим веществам в молекулярную «схему» ОВР | |
| (!!) - проверить правильность коэффициентов по числу О-атомов слева и справа в «схеме» ОВР. Если баланса О-атомов НЕТ: - отыскать «неучтенные» ИОНЫ в молекулах В-ЛЯ и О-ЛЯ исходной молекулярной «схемы» ОВР, - составить формулы молекул «недостающих» ПРОДУКТОВ с противоионами СРЕДЫ. |
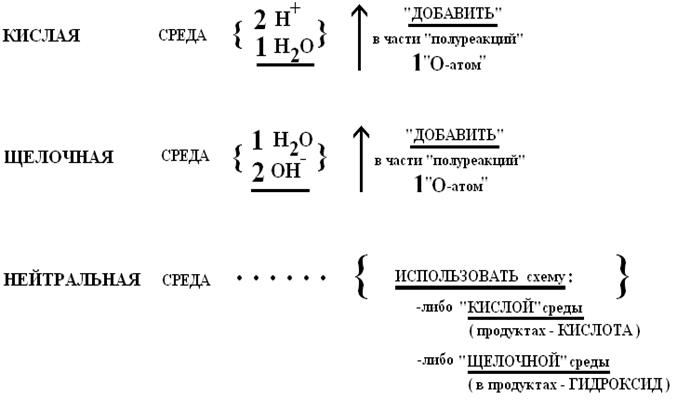
ПОДСКАЗКИ в «схемах» ОВР…(МОГУТ БЫТЬ ПОКАЗАНЫ В ЧИСЛЕ ПРОДУКТОВ, т.е. после знака ↔):
| СРЕДА | ОК-ЛЬ | |
| Cr2O72- | MnO41- | |
| КИСЛАЯ | Cr3+ | Mn2+ |
| НЕЙТРАЛЬНАЯ | ¹ | MnO2¯ |
| ЩЕЛОЧНАЯ | ¹ | MnO42- |
| СРЕДА | Н2О2Þ проявляет ОВ-ДВОЙСТВЕННОСТЬ | |
| Н2О2 Þ ОК-ЛЬ | Н2О2 Þ В-ЛЬ | |
| КИСЛАЯ | Н2О2 + 2Н+ + 2 ē = 2Н2О | Н2О2 - 2ē = О2 + 2Н+ |
| НЕЙТРАЛЬНАЯ | ¹ | ¹ |
| ЩЕЛОЧНАЯ | Н2О2 + 2 ē = 2 ОН- | Н2О2 + 2ОН- - 2ē = О2 + 2Н2О |
ОСНОВНЫЕ ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ - в ЛЮБЫХ реакциях Мео - только В-ЛИ:
Мео + (О-ЛЬ) + СРЕДА Þ …(продукты ОВР)
| РЯД АКТИВНОСТИ МЕТАЛЛОВ = ряд напряжений МЕТАЛЛОВ: |
| [АКТИВНЫЕ - (а) = Li, …, Mn], [ПОЛУАКТИВНЫЕ - (ср)= Zn, …, Pb], [H] [МАЛОАКТИВНЫЕ - (м) = Cu, Hg, Ag], [НЕАКТИВНЫЕ - (н) = …, Au, Pt.] |
| → ВОССТАНОВИТЕЛЬНАЯ активность Мео УМЕНЬШАЕТСЯ, ОКИСЛИТЕЛЬНАЯ активность Меn+ ВОЗРАСТАЕТ → |
CЛЕДСТВИЯ из ряда активности металлов:
1). БОЛЕЕ активные Мео металлы вытесняют катионы МЕНЕЕ активных Меn+ из их соединений,
2). Металлы Мео групп = (а, ср) вытесняют Н2 из КИСЛОТ, в которых Н+ = о-ль (HCl, …H2O, …H2SO4(разб.)),
3). «БЫСТРОТА» и активность вытеснения повышается с удалением взаимодействующих «ПАР»: Ме1, Ме2.
| СХЕМЫ взаимодействий металлов Мео групп = (а, ср, м) с растворами H2SO4(к), HNO3(p), HNO3(к) |
| Мео + H2SO4(к) =(to)Þ соль(*) + Н2О +{ H2S→ (a), S→ (ср), SO2→ (м) } соль(*) –содержит катион Меn+в возможно МИНИМАЛЬНОЙ положительной С.О. |
| Мео + HNO3(p) =(to)Þ соль(**) + Н2О +{ NH3→ (a), N2, N2O→ (ср), NO→ (м) } соль(**) -содержит катион Меn+ в возможно МАКСИМАЛЬНОЙ положительной С.О. |
| Мео + HNO3(к) =(to)Þ соль(***) + Н2О +{ N2O→ (а), NO→ (ср), NO2→ (м) } соль(***) –содержит катион Меn+в максимальной С.О. или представлена кислородсодержащей КИСЛОТОЙ |
НЕАКТИВНЫЕ, или благородные металлы группы = (н) взаимодействуют только с РАСПЛАВАМИ окислителей, а также c горячими РАСТВОРАМИ сильных ОКИСЛИТЕЛЕЙ: F2, O2, H2SeO4, HNO3+3HCl, …
(«АМФОТЕРНЫЙ» металл из групп = (а, ср) в расплаве или крепком растворе какой-либо щелочи)
Мео + ОН- + (Н2О) Þ Н2# + [«комплексная» низшая ОКСО-соль АМФОТЕРНОГО Меn+]
Окисление: Мео + … - n∙ ē → [«комплексный» анион низшей ОКСО-соли АМФОТЕРНОГО Меn+]
Восстановление: 2 H2O + 2∙ ē → H2# + 2 OH-
(«Амфотерный» металл только из групп = (а, ср) в расплаве или крепком растворе какой-либо щелочи)
Физико-химические процессы ЭЛЕКТРОХИМИИ: АНОД = ок-ние (–m∙ ē), КАТОД = восст-ние (+n∙ ē).
Самопроизвольно протекают ОВ-реакции в приборах, генерирующих постоянный электрический ток:
разнообразные ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ, АККУМУЛЯТОРЫ, КОРРОЗИОННЫЕ СИСТЕМЫ.
Вынужденно, под действием тока от внешнего источника - происходят процессы ЭЛЕКТРОЛИЗА веществ.
| ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ, АККУМУЛЯТОРЫ, … | ЭЛЕКТРОЛИЗ | |||
| АНОД заряжен ОТРИЦАТЕЛЬНО (А-), КАТОД заряжен ПОЛОЖИТЕЛЬНО (К+). | АНОД заряжен ПОЛОЖИТЕЛЬНО (А+), КАТОД заряжен ОТРИЦАТЕЛЬНО (К-). | |||
| Э/Х-схема: (А-) Ме1 | электролит | Ме2 (К+) или (А-) Ме1 | соль Ме1, См, 1 || соль Ме2, См, 2 | Ме2 (К+) | ||||
| АНОДНЫЕ электроды изготавливаются из БОЛЕЕ активного металла- Ме1 или из металла, который погружен в раствор электролита с МЕНЬШЕЙ концентрацией окисляющего вещества - См. | Наиболее сильные ОКИСЛИТЕЛИ - катионы из электролита восстанавливаются на катоде; наиболее сильные ВОССТАНОВИТЕЛИ- анионы из электролита окисляются на ИНЕРТНОМ аноде (графит, …); | |||
| Расчет потенциала электрода (ур-ние Нернста): ЕМеn+, Ме = ЕоМеn+, Ме + 0, 059∙ lg[Men+]/n | ПРАВИЛА разряда на электродах ГИДРАТИРОВАННЫХ ионов из электролита: | |||
| Е(катод) > Е(анод) Напряжение на электродах: rЕ = Е(катод) - Е(анод) | Катод (К-) | Анод (А+) | ||
| КОРРОЗИЯ металлических изделий: | НЕЛЬЗЯ восстановить катионы металлов - (а): Li+, Na+, K+, Rb+, Be2+, Mg2+, Ca2+, Ba2+, Al3+, … | НЕЛЬЗЯ окислить анионы F- и «кислородных» кислот: BO33-, PO43-, SO42-, NO3-, | ||
| Анодные участки (-) | Катодные участки (+) | реальный процесс: | ||
| Me - n ē ® Men+ | 1). Кислая среда: 2 Н+ + 2 ē ® Н2 2). Среда кислоты + О2: 4 Н+ + О2 + 4 ē ® 2 Н2О 3). «влажный воздух»: 2 Н2О + О2 + 4 ē ® 4 ОН- | 2 Н2О + 2 ē ® → Н2 + 2 ОН- | 2 Н2О - 4 ē ® О2 + 4 Н+ | |
| АКТИВНЫЙ анод растворяется сам: Me - n∙ ē ® Men+ | ||||
| Закон Фарадея: m(вещества) = Mэ(вещества)∙ I∙ t/F | ||||
h(вещества) = 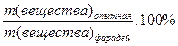
| ||||
| Ag+ + ē ® Ag | +0, 80 В | |||
| Zn2+ + 2 ē ® Zn | -0, 76 В | |||
| Cl2 + 2 ē ® 2 Cl- | +1, 36 В | |||
| O2 + 2 H2O + 4 ē ® 4 OH- | +0, 40 В | |||
| NO3- + H2O + 2 ē ® NO2- + 2 OH- | +0, 01 В | |||
| SO42- + 2 H+ + 2 ē ® SO32- + H2O | +0, 17 В | |||
| O2 + 2 H2O + 4 ē ® 4 OH- | +0, 40 В | |||
| Cr2O72- + 14 H+ + 6 ē ® 2 Cr3+ + 7 H2O | +1, 33 В | |||
| Cu2+ + 2 ē ® Cu | +0, 34 В | |||
| Fe2+ + 2 ē ® Fe | -0, 44 В | |||
| 2 H+ + 2 ē ® H2 | 0, 00 | |||
| 2 H2O + 2 ē ® H2 + 2 OH- | -0, 83 В | |||
| Sn2+ + 2 ē ® Sn | -0, 14 В | |||
| MnO4- + 8 H+ + 5 ē ® Mn2+ + 4 H2O | +1, 51 В | |||
| MnO4- + 2 H2O + 3 ē ® MnO2 + 4 OH- | +0, 59 В | |||
| MnO4- + ē ® MnO42- | +0, 54 В | |||
| ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ПРОТЕКАНИЯ ХИМИЧЕСКИХ РЕАКЦИЙ m A + n B = p C + q D (РАЗРЫВАЮТСЯ связи в молекулах реагентов)Þ (образуются БОЛЕЕ устойчивые молекулы ПРОДУКТОВ) | |||
| ЭНЕРГЕТИКА «определяет ВОЗМОЖНОСТЬ протекания реакции» | КИНЕТИКА «определяет БЫСТРОТУ реализации процесса» | ||
| ПОНЯТИЯ: система, окружающая среда, ±Q, процессы ЭКЗО-термические или ЭНДО-термические, U, H, G, Нf, DНfо, ±DН(реакции), S, Sfo, ±DS(реакции), DGf, DGfo, DG(реакции). (Численные значения этих величин даны в таблицах) | ПОНЯТИЯ: «быстрота» = СКОРОСТЬ взаимодействия веществ, V®; V, природа РЕАГЕНТОВ, концентрации и агрегатные состояния веществ, Р, Т, катализаторы, ОБРАТИМЫЕ (Û) системы, химическое равновесие и его смещения → и ←. | ||
| 1). закон Лапласа | Q(реакции) = -DН(реакции) | 1). уравнение Аррениуса: | k® или = Z∙ A∙ e-Ea/RT |
| 2). закон Гесса …следствие «ЗГ» №1: …следствие «ЗГ» №2: …следствие «ЗГ» №3: | DН(реакции) = Нконечное-Нначальное | 2). ЗДМ(закон действующих масс) или закон Гульдберга-Вааге: | V® = k®∙ C(A)m∙ C(B)n или V® = kр®∙ pm(Агаз)∙ pn(Вгаз) (m+n)£ 3! |
| DНo(р) = p∙ DНоf(C) +q∙ DНоf(D) -m∙ DНоf(A) -n∙ DНоf(B) | 3). правило Вант-Гоффа: |  ; (g=2÷ 4) ; (g=2÷ 4)
| |
| DSo(р) = p∙ Sfо(C) +q∙ Sfо(D) -m∙ Sfо(A) -n∙ Sfо(B) | 4). дополнительные вещества, влияющие на реакцию в(→) или (←) направлениях | КАТАЛИЗАТОРЫ – ускоряют; ИНГИБИТОРЫ - замедляют реакцию, меняя ее ЭНЕРГИЮ АКТИВАЦИИ - (Еа). | |
| DGo(р) = p∙ DGfо(C) +q∙ DGfо(D) -m∙ DGfо(A) -n∙ DGfо(B) | |||
| Возможность протекания реакции в заданных Р и Т: DG(реакции) = (DН(реакции) - Т∙ DS(реакции)) < 0; (ð) | ХИМИЧЕСКОЕ РАВНОВЕСИЕ (Û): V® = V Равновесные концентрации: [A], [B], [C], [D] | ||
| Взаимосвязь результатов расчетов энергетических и кинетических параметров реакции: | |||
| DG(реакции) = - R∙ T∙ lgKхр | 
| ||
| СДВИГИ РАВНОВЕСИЯ (принцип Ле-Шателье-Брауна) «Если на РАВНОВЕСНУЮ систему оказывается внешнее воздействие (DС, DТ, DР), то УСКОРЯЕТСЯ реакция (®) или (), ведущая к УМЕНЬШЕНИЮ этого воздействия»: 1). (DС): УВЕЛИЧЕНИЕ концентраций реагентов, УМЕНЬШЕНИЕ концентраций продуктов ускоряют – (→), обратные изменения [концентраций веществ] приведут к сдвигу их равновесия ВЛЕВО – (←), 2). (DТ): УВЕЛИЧЕНИЕ температуры в системе (Т) ускоряет ЭНДО-процесс (DН(реакции)> 0) УМЕНЬШЕНИЕ температуры в системе (Т) ускоряет ЭКЗО-процесс (DН(реакции)< 0) 3). (DР) ð действительно ТОЛЬКО в равновесиях «газообразных» веществ: увеличение Робщего (газов) Þ приводит к УМЕНЬШЕНИЮ объема - (V(системы)) уменьшение Робщего (газов) Þ приводит к УВЕЛИЧЕНИЮ объема - (V(системы)) |
ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ Д.И.Менделеева
(указаны №, символ, электронное семейство)
| ПЕРИОД | ГРУППА | |||||||
| I | II | III | IV | V | VI | VII | VIII | |
| подгруппа | ||||||||
| а б | а б | а б | а б | а б | а б | а б | а б | |
| I | (H), s- | 1, H, s- | 2, He, s- | |||||
| II | 3, Li, s- | 4, Be, s- | 5, B, p- | 6, C, p- | 7, N, p- | 8, O, p- | 9, F, p- | 10, Ne, p- |
| III | 11, Na, s- | 12, Mg, s- | 13, Al, p- | 14, Si, p- | 15, P, p- | 16, S, p- | 17, Cl, p- | 18, Ar, p- |
| IV | 19, K, s- | 20, Ca, s- | 21, Sc | 22, Ti | 23, V | 24, Cr | 25, Mn | Fe, Co, Ni |
| 29, Cu | 30, Zn | 31, Ga, p- | 32, Ge, p- | 33, As, p- | 34, Se, p- | 35, Br, p- | 36, Kr, p- | |
| V | 37, Rb, s- | 38, Sr, s- | 39, Y | 40, Zr | 41, Nb | 42, Mo | 43, Tc | Ru, Rh, Pd |
| 47, Ag | 48, Cd | 49, In, p- | 50, Sn, p- | 51, Sb, p- | 52, Te, p- | 53, I, p- | 54, Xe, p- | |
| VI | 55, Cs, s- | 56, Ba, s- | 57→ 71, La* | 72, Hf | 73, Ta | 74, W | 75, Re | Os, Ir, Pt |
| 79, Au | 80, Hg | 81, Tl, p- | 82, Pb, p- | 83, Bi, p- | 84, Po, p- | 85, At, p- | 86, Rn, p- | |
| VII | 87, Fr, s- | 88, Ra, s- | 89→ 103, Ac** | 104, Rf | 105, Db | 106, Sg | 107, Bh | Hs, Mt, … |
| элементы s-, p- и d -электронных семейств |
| «АМФОТЕРНЫЕ» элементы: Be, Al, Ti, V, Cr, Mn, Fe, Zn, Ga, Ge, Zr, Nb, Mo, Tc, Sn, Sb, Hf, Ta, W, Re, Au, Pb, Bi, Po, |
| ИНЕРТНЫЕ или «благородные газы» - элементы, завершающие текущий период |
| Принятые наименования: щелочные, щелочно-земельные, благородные металлы, халькогены, галогены |
*ЛАНТАНОИДЫ - (все 4f - элементы расположены в клеточке №57 = La* внутри периодической таблицы)
| Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu |
**АКТИНОИДЫ - (все 5f - элементы расположены в клеточке №89 = Ac** внутри периодической таблицы)
| Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | |||||
| кислота | соли | |||||||||||||||||
| название | ЭД кислот | формула | кислотный остаток | название аниона | ||||||||||||||
| КИСЛОРОДСОДЕРЖАЩИЕ кислоты и их соли | ||||||||||||||||||
| Азотная | HNO3 | NO3- | Нитрат | |||||||||||||||
| Азотистая | слабая | HNO2 | NO2- | Нитрит | ||||||||||||||
| Алюминиевая (мета) | слабая | HAlO2 | AlO2- | Мета-алюминат | ||||||||||||||
| Бериллиевая | слабая | H2BeO2 | BeO22- | Бериллат | ||||||||||||||
| Борная (орто) | слабая | H3BO3 | BO33- | Орто-борат | ||||||||||||||
| Борная (тетра) | слабая | H2B4O7 | B4O72- | Тетраборат | ||||||||||||||
| Висмутовая | HBiO3 | BiO3- | Висмутат | |||||||||||||||
| Железная | H2FeO4 | FeO42- | Феррат | |||||||||||||||
| Железистая (мета) | слабая | HFeO2 | FeO2- | Феррит | ||||||||||||||
| Кремниевая (мета) | слабая | H2SiO3 | SiO32- | Мета-силикат | ||||||||||||||
| Марганцовая | HMnO4 | MnO4- | Перманганат | |||||||||||||||
| Марганцовистая | H2MnO4 | MnO42- | Манганат | |||||||||||||||
| Молибденовая | H2MoO4 | MoO42- | Молибдат | |||||||||||||||
| Мышьковая (орто) | слабая | H3AsO4 | AsO43- | Орто-арсенат | ||||||||||||||
| Оловянная (мета) | слабая | H2SnO3 | SnO32- | Мета-станнат | ||||||||||||||
| Оловянистая | слабая | H2SnO2 | SnO22- | Станнит | ||||||||||||||
| Селеновая | H2SeO4 | SeO42- | Селенат | |||||||||||||||
| Свинцовая (мета) | слабая | H2PbO3 | PbO32- | Мета-плюмбат | ||||||||||||||
| Свинцовистая | слабая | H2PbO2 | PbO22- | Плюмбит | ||||||||||||||
| Серная | H2SO4 | SO42- | Сульфат | |||||||||||||||
| Дисерная | H2S2O7 | S2O72- | Дисульфат | |||||||||||||||
| Тиосерная | слабая | H2S2O3 | S2O32- | Тио-сульфат | ||||||||||||||
| Сернистая | слабая | H2SO3 | SO32- | Сульфит | ||||||||||||||
| Сурьмяная (мета) | слабая | HSbO3 | SbO3- | Мета-антимонат | ||||||||||||||
| Теллуровая | H2TeO4 | TeO42- | Теллурат | |||||||||||||||
| Угольная | слабая | H2CO3 | CO32- | Карбонат | ||||||||||||||
| Муравьиная | слабая | HCOOH | HCOO- | Формиат | ||||||||||||||
| Уксусная | слабая | CH3COOH | CH3COO- | Ацетат | ||||||||||||||
| Фосфорная (орто) | слабая | H3PO4 | PO43- | Орто-фосфат | ||||||||||||||
| Фосфорная (мета) | слабая | HPO3 | PO3- | Мета-фосфат | ||||||||||||||
| Дифосфорная | слабая | H4P2O7 | P2O74- | Дифосфат | ||||||||||||||
| Фосфористая (мета) | слабая | HPO2 | PO2- | Мета-фосфит | ||||||||||||||
| Хромовая | H2CrO4 | CrO42- | Хромат | |||||||||||||||
| Дихромовая | H2Cr2O7 | Cr2O72- | Дихромат | |||||||||||||||
| Хромистая (мета) | слабая | HCrO2 | CrO2- | Мета-хромит | ||||||||||||||
| кислоты и соли с атомами CI, Br, I – ПОДОБНЫ | ||||||||||||||||||
| Хлорная | HClO4 | ClO4- | Пер-хлорат | |||||||||||||||
| Хлорноватая | HClO3 | ClO3- | Хлорат | |||||||||||||||
| Хлористая | слабая | HClO2 | ClO2- | Хлорит | ||||||||||||||
| Хлорноватистая | слабая | HClO | ClO- | Гипо-хлорит | ||||||||||||||
| БЕСКИСЛОРОДНЫЕ кислоты и их соли | ||||||||||||||||||
| Фтороводородная | слабая | HF | F- | Фторид | ||||||||||||||
| Хлороводородная | HCl | Cl- | Хлорид | |||||||||||||||
| Бромоводородная | HBr | Br- | Бромид | |||||||||||||||
| Иодоводородная | HI | I- | Иодид | |||||||||||||||
| Циановодородная | слабая | HCN | CN- | Цианид | ||||||||||||||
| Тиоциановодородная | слабая | HSCN | SCN- | Тио-цианид | ||||||||||||||
| Селеноводородная | слабая | H2Se | Se2- | Селенид | ||||||||||||||
| Сероводородная | слабая | H2S | S2- | Сульфид | ||||||||||||||
|
|