
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Цель работы: изучение зависимости скорости химической реакции от концентрации реагирующих веществ, температуры и катализатора.
|
|
КРАТКИЕ ТЕОРЕТИЧЕСКИЕ ОСНОВЫ РАБОТЫ
Гомогенная реакция
__________________________________________________________________
Гетерогенная реакция
__________________________________________________________________
Скоростью химической реакции называется
______________________________________________________________________________________________________________________________________________________________________________________________________
Скорость реакции зависит от следующих факторов:
1._________________________________________________________________
2._________________________________________________________________
3._________________________________________________________________4.___________________________________________________________________________________________________________________________________
Зависимость скорости химической реакции от концентрации (или давления) реагирующих веществ выражается
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Влияние температуры на скорость реакции описывается
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Энергия активации реакции
______________________________________________________________________________________________________________________________________________________________________________________________________измеряется_________________________________________________________
Опыт 1. Зависимость скорости химической реакции от концентрации реагирующих веществ.
Исследуемая реакция: _______________________________________________
Закон действующих масс для этой реакции:
__________________________________________________________________
Таблица 2.1
| № пробирки | Объем, мл | Относительная концентрация | Время t начала помутнения, с | Относительная скорость | |||
| Na2S2O3 | H2O | H2SO4 | Vтеор. | Vпракт. | |||
Вывод:
____________________________________________________________________________________________________________________________________
Опыт 2. Зависимость скорости химической реакции от температуры.
Правило Вант-Гоффа:
____________________________________________________________________________________________________________________________________
Зависимость скорости реакции от температуры:
__________________________________________________________________
Уравнение Аррениуса:
__________________________________________________________________
Таблица 2.2
| № пробирки | Объем, мл | Температура опыта, 0С | Время t начала помутнения раствора, с | Относительная скорость | |
| Na2S2O3 | H2SO | ||||
| V1 = 1 | |||||
| V2 | |||||
| V3 |
Расчет температурного коэффициента:
γ ср. = (γ 1 + γ 2)/2, если γ 1 = 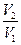 , γ 2 =
, γ 2 = 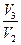 .
.
__________________________________________________________________
γ 1 =; γ 2 =; γ ср. =.
Вывод:
______________________________________________________________________________________________________________________________________________________________________________________________________
Опыт 3. Влияние катализатора на скорость химической реакции.
Катализатором называют
______________________________________________________________________________________________________________________________________________________________________________________________________
Катализ – это
____________________________________________________________________________________________________________________________________
Исследуемая реакция: _______________________________________________
Наблюдаемые явления:
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________Вывод:
____________________________________________________________________________________________________________________________________
|
|