
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Лекция № 1.
|
|
Биохимия, её задачи. Структурная организация белков.
1.Предмет биохимии.
2.Задачи биохимии.
3.Значение биохимии для медицины.
4.Белки, их биологическая роль.
5.Структурная организация белков.
Биохимия относится к фундаментальным дисциплинам медицины и биологии. В результате научного познания мира выделился ряд фундаментальных дисциплин: философия, физика, химия, биология и д.р. Биохимия выделилась с одной стороны в результате разделения наук. Ей не доставало точности, т.к. длительно она была описательной наукой. Середина 20 в. ознаменовалась глобальными открытиями в физике. В это же время интеграция биологии с точными науками способствовала её бурному развитию. Биохимия возникла как наука, благодаря привлечению в биологию точных знаний, в частности химии.
Биохимия—наука о структуре веществ, входящих в состав живого организма, их превращениях и физико-химических процессах, лежащих в основе жизнедеятельности.
Выделяют три составных компонента общей биохимии:
1.Статическая биохимия (изучает структуру веществ) - биоорганическая химия.
2.Динамическая биохимия (изучает превращение веществ в организме).
3.Функциональная биохимия (изучает процессы, лежащие в основе функций органов и тканей). Кроме общей (базисной) биохимии выделяют ещё ряд разделов биохимии, в зависимости от направления проводящихся исследований:
1.Биохимия растений.
2.Биохимия микроорганизмов.
3.Биохимия животных.
4.Медицинская биохимия.
5.Ветеринарская биохимия.
6.Техническая биохимия.
7.Биохимия генетики.
8.Молекулярная биохимия.
Задачи биохимии.
1.Изучение процессов БИОКАТАЛИЗА.
2.Изучение механизмов наследственности на молекулярном уровне.
3.Изучение строения и обмена нуклеиновых кислот.
4.Изучение строения и обмена белков.
5.Изучение превращения углеводов.
6.Изучение обмена жиров.
7.Изучение биологической роли сигнальных молекул (ГОРМОНЫ, НЕЙРОМЕДИАТОРЫ).
8.Изучение роли витаминов в обмене веществ.
9.Изучение роли минеральных веществ.
Значение биохимии для медицины.
Основные вопросы медицины: патогенез, диагностика, лечение и профилактика заболеваний.
1.Значение биохимии для понимания механизма заболевания.
ПРИМЕР. В норме, ГЕМОГЛОБИН-А располагается в эритроцитах равномерно, занимая весь объём клетки. При смене 1 АК ГЛУТАМИНА на ВАЛИН образуется ГЕМОГЛОБИН-S, плохо растворимый и выпадающий в эритроцитах в осадок. Сущность этого заболевания раскрыл Л. ПОЛЛИНГ. Только биохимические исследования позволяют диагностировать это заболевание и раскрыть механизм развития вследствие недостатка гормона инсулина. Сердечно-сосудистые заболевания (атеросклероз). Раньше считали, что важную роль в патогенезе принадлежит накоплению ЛИПОПРОТЕИНОВ низкой плотности и нарушение соотношения между ЛИПОПРОТЕИНАМИ низкой плотности и ЛИПОПРОТЕИНАМИ высокой плотности. В настоящее время предполагают, что важным является чувствительность рецепторов клеток к ЛИПОПРОТЕИНАМ низкой плотности.
2.Значение биохимии для диагностики заболеваний.
Широкое использование биохимических исследований биологических жидкостей.
A. Количество субстратов.
Б. Исследование активности ферментов.
B. Исследование уровня гормонов. Методы РИА, ИФА, ИХЛА, ДНК-зонды.
Важным моментом в настоящее время является выявление ПРЕДЗАБОЛЕВАНИЙ.
3. Значение биохимии для лечения. Выявление нарушенных звеньев метаболизма и создание соответствующих лекарственных препаратов, широкое использование природных препаратов.
4.Значение биохимии для профилактики заболеваний.
ПРИМЕР. Недостаток витамина С —цинга—для профилактики использование витамина С (профилактика простудных заболеваний).
Недостаток витамина D— рахит— использование витамина D.
БЕЛКИ, ИХ БИОЛОГИЧЕСКАЯ РОЛЬ.
Белки - это высокомолекулярные азотсодержащие органические вещества, состоящие из АК. соединённых ПЕПТИДНЫМИ связями в ПОЛИПЕПТИДНУЮ цепь, и имеющие сложную структурную организацию.
Характерные признаки белков, отличающие их от других соединений:
1.Белки - АЗОТСОДЕРЖАЩИЕ вещества (до 16 %).
2.Структурной единицей белков являются альфа АК L-РЯДА.
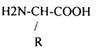
3-.АК связываются ПЕПТИДНЫМИ связями в ПОЛИПЕПТИДНУЮ цепь.
4.Большая молекулярная масса белков (от 20000 до нескольких миллионов дальтон).
5.Сложная структурная организация.
ФУНКЦИИ БЕЛКОВ.
1.Каталитическая. Многие белки являются ферментами
2.Регуляторная. Некоторые гормоны являются белками
3.Структурная. Во все структуры живой клетки входят белки.
4.Рецепторная. Белки являются обязательным компонентом рецепторов, способны узнавать другие молекулы.
5.Транпортная. Транспорт жиров, лекарственных веществ и д.р.
6.Опорная. Коллаген, белки костной ткани.
7.Энергетическая. Окисление 1 грамма белка сопровождается выделением 17 КДЖ энергии. В сутки 15% энергии образуется за счёт распада Б.
8.Сократительная. Актин, миозин мышц.
9.Генно-регуляторная (ГИСТОНЫ).
10.Иммунологическая. Антитела являются белками.
11.Гемостатическая. Фибриноген.
СТРУКТУРНАЯ ОРГАНИЗАЦИЯ БЕЛКОВ. Свойства белков обусловлены их структурой.
ПЕРВИЧНАЯ СТРУКТУРА - последовательное соединение АК в ПОЛИПЕПТИДНОЙ цепи с помощью ПЕПТИДНЫХ связей.
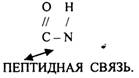
Свойства ПОЛИПЕПТИДНОЙ цепи зависят от составляющих её АК.
Порядок АК в цепи устанавливается с помощью СЕКВЕНИРОВАНИЯ - процедура выявления последовательности АК. Впервые было проведено в 1958 г. Ф. СЕНДЖЕРОМ на инсулине.
ВТОРИЧНАЯ СТРУКТУРА - способ укладки в пространстве ПОЛИПЕПТИДНОЙ цепи. Образуется за счет водородных связей между 1 и 4 АК.
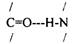
Выделяют 3 вида вторичной структуры:
1.Альфа спираль (Л.ПОЛЛИНГ) - виток составляет от 3 до 6 АК. Терминатором спирали является АК-ПРОЛИН.
2.Бетта складчатый слой.
3.Петли ПОЛИПЕПТИДНОЙ цепи (соединительные петли).
ТРЕТИЧНАЯ СТРУКТУРА - укладка вторичной структуры более компактно, в виде ГЛОБУЛЫ или ФИБРИЛЛЫ. Осуществляется за счёт водородных, ионных, ДИСУЛЬФИДНЫХ и гидрофобных связей.
Домены - это фрагменты ПОЛИПЕПТИДНОЙ цепи, сходные по свойствам с самостоятельными глобулярными белками. Домен автономен. Домены возникают в результате слияния нескольких генов отдельных белков.
ЧЕТВЕРТИЧНАЯ СТРУКТУРА - объединение нескольких доменов. П. Гемоглобин-4 СУБЪЕДИНИЦЫ.
ЛЕКЦИЯ № 2.
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА БЕЛКОВ. КЛАССИФИКАЦИЯ БЕЛКОВ.
1.Физико-химические свойства белков. Их использование для разделения белков.
2.Принципы классификации белков.
3.Характеристика простых белков.
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА БЕЛКОВ.
1.Молекулярная масса белков определяет многие свойства белков: седиментация, диффузия, плотность белковых растворов, коллоидные свойства белков и др. характеристики.
Молекулярная масса: инсулин (5700)
МИОГЛОБИН (17000)
ПЕПСИН (35000)
ГЕМОГЛОБИН (65000).
Молекулярную массу белка можно определить по скорости седиментации (осаждения) при УЛЬТРАЦЕНТРИФУГИРОВАНИИ, т.е. при ускорении 100000-500000 дальтон. На основании этого определяют коэффициент седиментации, который обозначают S (в честь СВЕДБЕРГА). Он предложил за единицу коэффициента седиментации величину 10-13 степени. S большинства белков колеблется в пределах 1-2 СВЕДБЕРГОВ. Др. методом определения молекулярной массы является метод ГЕЛЬФИЛЬТРАЦИИ (молекулярное просеивание). Используется искусственно созданные гранулы, имеющие поры (гранулы СЕФАДЕКСА). Внутрь гранулы могут проникать только соединения определённого размера: молекулы небольшого размера входят в гранулы, а большие быстрее вымываются. Молекулярная масса рассчитывается ориентировочно. Буфер не задерживается, а белок движется тем медленнее, чем меньше молекулярная масса.
2.Способность белков связываться с ЛИГАНДАМИ, ж
Белки способны связываться с определенными веществами. Белки специфично узнают свои ЛИГАНДЫ, что обусловлено комплиментарным строением определённого участка белка и ЛИГАНДЫ.
Fe2+ O2. ИЗБИРАТЕЛЬНОСТЬ обеспечивается белковой частью гемоглобина. Центр связывания ЛИГАНДА называется активным центром. Это свойство лежит в основе др. метод разделения белков - АФФИНАЯ ХРОМОТОГРАФИЯ (разделение по сродству).
3.Электрохимические свойства белков.
А. АМФОТЕРНОСТЬ.
Белки - АМФОТЕРНЫЕ ЭЛЕКТРОЛИТЫ.

АМФОТЕРНОСТЬ обусловлена:
1. Концевыми СООН и NH2 группами.
2.Боковыми группами:
ГЛУ, АСП -дополнительные кислотные СВОЙВТВА. АРГ, ЛИЗ, ГИС - основные свойства.
Т.к. белковые молекулы имеют много ИОНОГЕННЫХ групп, следовательно, они ПОЛИЭЛЕКТРОЛИТЫ. БЕЛКИ являются АМФОЛИТАМИ.
Б. Буферные свойства - способность поддерживать РН среды. Наиболее мощным буфером крови является ГЕМОГЛОБИНОВЫЙ буфер, т.к. в большом количестве содержит ГИСТИДИН.
B. Белки содержат заряд, который зависит от соотношения кислотных и основных групп, а оно в свою очередь зависит от их диссоциации, определяющейся РН среды.
Изоэлектрическое состояние - это состояние молекулы белка, при котором её заряд равен 0. Значение РН, при котором белок находится в изоэлектрическом состоянии, называется изоэлектрической точкой.
PI кислые белки< 7 (белки протоплазмы)
РI основные белки > 7 (ядерные белки).
В изоэлектрическом состоянии белок менее устойчив. Это свойство белков используется при их ФРАКЦИВАНИИ:
1.ИОНООБМЕННАЯ ХРОМАТОГРАФИЯ.
Для неё используется ИОНООБМЕННИКИ, которые изготавливаются из чистой целлюлозы: ДЭАЭ - целлюлоза (содержит катионные группы); КМ - целлюлоза (содержит анионные группы). На ДЭАЭ разделяют отрицательно заряженные белки, на КМ - положительно заряженные. Чем больше в белке СООН групп, тем прочнее он связывается с ДЭАЭ целлюлозой.
2.Разделение белков на основании величины заряда - электрофорез белков. С помощью электрофореза в сыворотке крови выделяют как минимум 5 фракций: АЛЬБУМИНЫ, альфа, альфа-2, гамма, бета - глобулины.
3.Коллоидные свойства белков.
Белковые растворы весьма устойчивы, их иногда относят к истинным растворам, высокая молекулярная масса придаёт белковым растворам коллоидные свойства.
A. Оптические свойства:
- ОПАЛЕСЦЕНЦИЯ - дифракция световых лучей при прохождении через раствор и, следовательно, наблюдение его некоторого потемнения при взгляде под прямым углом к источнику света.
- Рассеивание света (конус ТИНДАЛЯ).
Оптические свойства используются в световой микроскопии, нефелометрии, ТУРБОДИМЕТРИИ.
При нефелометрии измеряется интенсивность отраженного света. При ТУРБОДИМЕТРИИ измеряется интенсивность проходящего света.
Б. Высокая вязкость растворов белка.
B. Малая скорость диффузии.
Г. Неспособность белков проникать через полупроницаемые мембраны. Давление, обусловленное белками, называется ОНКОТИЧЕСКИМ. Диализ - очистка белковых растворов
от низкомолекулярных веществ. В клинике используется ГЕМОДИАЛИЗ - очистка крови от азотистых компонентов.
Д. Способность белковых растворов переходить из состояния золя в гель. Гель хорошо образует миозин и др. фибриллярные белки.
4. Гидратация белков - способность белков связывать воду. Она осуществляется за счёт:
-полярных групп;
-ПЕПТИДНЫХ связей.
100 г. белка связывает 30-35 г. воды. Способность связывать воду изменяется с возрастом. Вода может проникать в молекулы и связываться с внутренними структурами белка, и образованием раствора воды в белке. Вода может связываться и с наружными структурами белка с образованием ГИДРАТНОЙ оболочки.
5. Растворимость белков в воде (устойчивость белков в водном растворе). Многие белки хорошо растворимы в воде, что определяется количеством полярных групп. Растворимость глобулярных молекул лучше, чем фибриллярных белков. Факторы, определяющие стабильность белковых растворов:
- наличие зарядов в белковой молекуле. Одноименные заряды способствуют растворимости белка, т.к. препятствуют соединению молекул и выпадению в осадок.
- Наличие ГИДРАТНОЙ оболочки, препятствующей объединению белковых молекул. Для осаждения белка, его необходимо лишить этих двух факторов устойчивости. Методом осаждения белка является вливание - осаждение белка с помощью нейтральных солей - (NH4)2-S04.
В полунасыщенном растворе (NH4)2-SO4 осаждаются глобулины, а в насыщенном - альбумины.
После удаления осаждающего фактора, белки переходят в растворённое состояние.
6.ЛАБИЛЬНОСТЬ пространственной структуры белка. Под действием внешних факторов может происходить нарушение высших уровней организации белковой молекулы (вторичной, третичной, четвертичной структур) при сохранении первичной структуры. При этом белок теряет свои НАТИВНЫЕ, физико-химические и биологические свойства. Это явление называется денатурацией. Денатурацию вызывают химические факторы (повышение температуры, давления, механическое воздействие, УЗ, ионизирующее излучение), химические факторы (кислоты, щелочи, органические растворители -спирт, фенол; соли тяжёлых металлов).n В некоторых случаях возможна РЕНАТУРАЦИЯ, когда денатурирующий фактор действовал кратковременно и нанёс лёгкое разрушение молекуле. В последние годы установлено, что в организме есть белковые системы предупреждающие денатурацию. Они тоже белковой природы - ШАПЕРОНЫ - класс белков, защищающий в условиях клетки др. белки от денатурации. Они облегчают формирование пространственной конфигурации белков. К ним относятся белки теплового шока или белки стресса.
КЛАССИФИКАЦИЯ БЕЛКОВ.
1.По функции выделяют:
1. Транспортные белки (гемоглобин ® О2, альбумин жирные кислоты).
2. Каталитические (ферменты),
3. Регуляторные (гормоны).
4. Структурные (белки соединительной ткани, мембранные белки).
5. Защитные (антитела).
6. Сократительные (актин, миозин).
7. Рецепторные участвуют в образовании рецепторов.
2. По форме выделяют:
1. Глобулярные.
2. Фибриллярные белки.
3. По структуре белки делятся:
1.Простые (ПРОТЕИНЫ) состоят только из АК (ГИСТОНЫ, ПРОТАМИНЫ, АЛЬБУМИНЫ, ГЛОБУЛИНЫ, ГЛЮТЕМИНЫ, ПРОЛОНГИНЫ, ПРОТЕИНОИДЫ).
2.Сложные (ПРОТЕИДЫ) состоят из белков и небелковой части. Белковая часть -АПОПРОТЕИНЫ+ ПРОСТЕТИЧЕСКАЯ группа = ХОЛОПРОТЕИНЫ. Это НУКЛЕОПРОТЕИНЫ, ЛИПОПРОТЕИНЫ, ГЛИКОПРОТЕИНЫ, ХРОМОПРОТЕИНЫ, ФОСФОПРОТЕИНЫ, МЕТАЛЛОПРОТЕИНЫ.
|
|