
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Химическая природа ферментов
|
|
Ферменты могут иметь все четыре уровня структурной организации: первичную, вторичную, третичную и четвертичную. Большинство ферментов имеют четвертичную структуру. По химической природе фермент могут быть белками простыми (ферменты протеины) и сложными (ферменты протеиды). Каталитическая функция ферментов определяется наличием одного или нескольких активных центров. Активный центр – это участок в пространственного структуре фермента, с которым связывается субстрат и подвергается химическому превращению. Число активных центров может быть равно числу субъединиц в четвертичной структуре фермента, т.е. сколько субъединиц (протомеров), столько активных центров.
В активном центре условно выделяют два участка: - контактный (якорный или субстратный), отвечающий за специфичность связывания субстрата (узнавание); - каталитический, где происходит химическое превращение субстрата после его связывание (сначала фермент узнает субстрат, притягивает его, затем субстрат располагается в этом активном центре.
Структурная организация фермента 1. Особенности образования активного центра у ферментов протеинов (простых белковых ферментов).
Обычно он образован 12-16 аминокислотными остатками полипептидной цепи. Иногда их число больше. Аминокислоты, формирующие активный центр, находятся в разных местах полипептидной цепи. При пространственной укладки белка-фермента (в третичную структуру), они сближаются и образуют активный центра.
Приблизительно 1/2 – 1/3 аминокислот фермента прямо или косвенно участвуют в работе активного центра.
2. Особенности образования активного центра у ферментов-протеидов (сложных белков-ферментов).
Протеиды состоят из: Апофермент (белковая часть) + кофактор (небелковая часть) = холофермент (активный комплекс). Кофактор (или простетическая группа) чаще всего предствавлен витаминами или ионами металлов. Холофермент в диссоциированном состоянии неактивен. У ферментов-протеидов главную роль в катализе играют кофакторы, а боковые радикалы аминокислот и их функциональные группы в апоферменте отвечают за специфичность связывания с субстратом и регуляторами (активаторами и ингибиторами) Таким образом, якорный участок активного центра и регуляторные центры находятся в апоферменте. Кинетика ферментативных реакций – этот раздел энзимологии изучает зависимость скорости ферментативной реакции от условий взаимодействий субстрата с ферментом (в том числе от факторов среды). Основы были заложены в работах Михаэлиса и Ментен. Скорость ферментативной реакции определяется количеством вещества (субстрата), которое превращается в единицу времени.
Скорость является мерой способности фермента катализировать реакцию и обозначается как активность фермента. Измерить активность фермента можно только косвенно: по концентрации превращаемого субстрата или нарастанию концентрации продукта в единицу времени. Скорость ферментативной реакции зависит от: 1. концентрации субстрата; 2. концентрации фермента; 3. реакции характера рН-среды; 4. температуры
Зависимость скорости ферментативной реакции от температуры. В определенном ограниченном интервале температур скорость ферментативной реакции увеличивается с ростом температуры. Повышение скорости реакции по мере приближения к оптимальной температуре (от 0 до 40°С) объясняется увеличением кинетической энергии реагирующих молекул. При дальнейшем увеличении температуры кинетическая энергия молекулы фермента становиться достаточной для разрыва связей, поддерживающих вторичную, третичную и четвертичную структуру фермента в нативном состоянии. Это приводит к тепловой денатурации фермента.
При низкой температуре происходит обратимая инактивация фермента, т.к. наблюдаются незначительные изменения конформации активного центра фермента.
Фермент имеет белковую природу, поэтому температура на него, влияет также как на белок (повышении температуры приводит к денатурации).
Общие черты ферментативного и неферментативного катализа: а) ускорение лишь термодинамически возможных реакции; т.е. они не могут возбудить реакций, противоречащих законам термодинамики, ускоряют только те реакции, которые могут протекать и без них.
б) ускорение достижения термодинамического равновесия химических реакций без изменения направления реакций и точки равновесия;
в) увеличение скорости химической реакции вследствие снижения энергии активации за счет снижения энергии переходного состояния (энергетического барьера) без изменения свободной энергии исходных веществ и продуктов реакции;
г) действие в ничтожно малых количествах;
д) катализаторы и ферменты не входят в состав конечных продуктов реакции и выходят из реакции в неизменном виде, они не расходуются в процессе катализа.
Особенности ферментативного катализа (определяются белковой природой ферментов):
а) по химическому строению молекулы ферментов являются белками;
б) более высокая каталитическая активность, эффективность ферментов на несколько порядков выше, чем небиологических катализаторов;
б) более высокая степень субстратной специфичности и специфичности действия;
в) мягкие условия катализа - относительно низкий температурный оптимум (36-400С), оптимум рН, близкий к нейтральному, низкое давление (1 атмосфера);
г) регулируемость ферментов. Через регуляцию ферментативного аппарата осуществляется скоординированность всех метаболических процессов во времени и пространстве
д) отсутствие побочных продуктов.
Основные свойства ферментов как биологических катализаторов
Известно, что для осуществления химической реакции необходимо, чтобы реагирующие вещества имели суммарную энергию выше, чем величина, называемая энергетическим барьером реакции. Для характеристики величины энергетического барьера введено понятие энергии активации. Преодоление энергии активации в химической реакции достигается либо увеличением энергии взаимодействующих молекул, например нагреванием, облучением, повышением давления, либо снижением требуемых для реакции затрат энергии (т.е. энергии активации) при помощи катализаторов.
Суть работы ферментов в том, что они снижают энергетический барьер реакции, т.е. вовлекают в реакцию даже те молекулы, которые без ферментов не могут вступить в реакцию, а при снижении энергетического барьера реакция становится возможной. Вместо одной реакции с высоким энергетическим барьером, начинает протекать несколько новых реакций с низким барьером (по обходному пути).
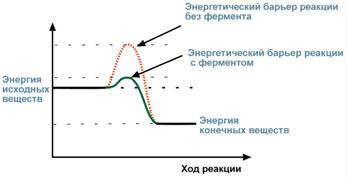
Величина энергии активации с ферментом и без него

|
|