
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
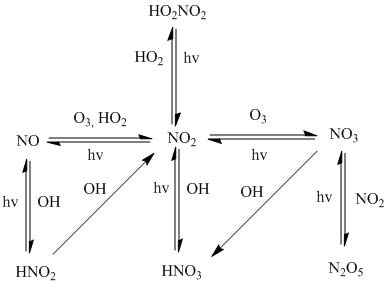
Практическая часть. 1. Пользуясь схемой, составьте уравнения реакций, происходящих в атмосфере вблизи источника выбросов оксидов азота (например
|
|
Выполните задание:
1. Пользуясь схемой, составьте уравнения реакций, происходящих в атмосфере вблизи источника выбросов оксидов азота (например, котельной) в солнечную безветренную погоду. В атмосфере постоянно присутствуют: озон, радикалы ОН· и НО2.
2. Составьте схемы реакций превращения первичных продуктов: NO, N2O3, N2O5, HNO2, HO2NO2, NO3(реакции, которые идут при λ < 290 нм отбрасываются).
3. Пользуясь справочными данными определите константы скоростей реакций при соответствующих температурах (ориентируясь на температурный градиент атмосферы).
4. Из основных циклов превращений поллютантов выберите самые быстрые реакции, отвечающие за трансформацию основной массы атмосферной примеси.
5. Сделайте вывод, ответив на вопрос: какие продукты цикла оксида азота являются основными компонентами смога?
Общая схема химических превращений оксидов азота в атмосфере:
Решите расчётные задачи:
1 Сравните скорости выведения из атмосферы молекул метана при их взаимодействии с гидроксидным радикалом в приземном слое и на высоте верхней границы стандартной тропосферы. Концентрация метана на этих высотах равна 1, 7 млн-1. Энергия активации и предэкспоненциальный множитель для реакции взаимодействия метана с ОН-радикалом равны 14, 1 кДж/моль и 2, 3 см3 • с-1 соответственно. Концентрации гидроксидных радикалов на этих высотах принять равными: [ОН]1 = 5 • 105 см-3, [ОН]2 = 2 • 106 см-3.
2. Определите, каким будет соотношение скоростей процессов газофазного и жидкофазного окисления SО2, если принять, что основной вклад вносят следующие реакции:
SО2{г) + ОН(г)? HSO3(г) (1)
SО2{р-р) + Н2О2(р-р)? Н2SO4(р-р) (2)
Константы скоростей реакций окисления: k1 = 9∙ 10-13 см3 ∙ с-1; k2 = 1 ∙ 103 л ∙ моль-1 ∙ с-1. Концентрации примесей в газовой фазе составляют: [ОН] = 5 ∙ 106 см-3, [SO2] = 10-4 % (об.); [Н2О2] = 10-7 % (об.).
Расчеты провести для атмосферного воздуха, имеющего температуру 25о С и содержащего 0, 00001 г свободной воды в каждом литре воздуха, Считать, что при растворении в воде концентрация SО2 в газовой фазе не меняется. Газы считать идеальными и подчиняющимися закону Генри. Давление принять равным 1 атм.
3. Какое было бы отношение концентраций NO и NO2 в равновесной системе на высоте 11 км, если их взаимную трансформацию можно было бы ограничить следующими реакциями:
М + NO + О = NO2 + М*, если М — молекулы кислорода
NO2 + О = + NO + О2?
Константы скорости реакций на этой высоте равны соответственно: k1 = 8 ∙ 10-32 см6 ∙ с-1,;
k2 = 1∙ 10-12 см3∙ с-1.
Задание 1. Рассчитайте время полувыведения оксида азота из приземного слоя атмосферного воздуха и определите, какой из процессов – окисление кислородом воздуха или окисление озоном - вносит основной вклад в трансформацию NO при заданных условиях.
Исходные данные: константа окисления кислородом при 298 К равна 1, 93 ∙ 10-38 ; температурная зависимость – 3, 3∙ 10-39ехр(530/Т); константа окисления озоном при 298 К равна 1, 8 ∙ 10-14, температурная зависимость 1, 4∙ 10-12ехр(-1310/Т)
Варианты заданий:
| Вариант | Содержание молекул NO, см-3 | Температура, оС | Давление, кПа | Концентрация О3, млрд-1 | |
| 20, 0 | 101, 3 | 10, 0 | |||
| 18, 0 | 101, 3 | 12, 0 | |||
| 2∙ 109 | 15, 5 | 101, 3 | 15, 0 | ||
| 10, 0 | 101, 3 | 14, 0 | |||
| 12, 0 | 101, 3 | 13, 0 | |||
| 11, 5 | 101, 3 | 10, 5 | |||
| 8, 0 | 101, 3 | 11, 5 | |||
| 10, 5 | 101, 3 | 12, 5 | |||
| 11, 0 | 101, 3 | 15, 5 | |||
| 14, 0 | 101, 3 | 14, 5 | |||
| 13, 5 | 101, 3 | 13, 5 | |||
| 13, 0 | 101, 3 | 9, 0 | |||
| 12, 5 | 101, 3 | 15, 8 | |||
| 7, 5 | 101, 3 | 9, 6 | |||
| 6, 0 | 101, 3 | 11, 7 | |||
| 5, 0 | 101, 3 | 8, 8 | |||
| 6, 5 | 101, 3 | 16, 0 | |||
| 5, 5 | 101, 3 | 16, 9 | |||
| 4, 0 | 101, 3 | 17, 0 | |||
| 17, 0 | 101, 3 | 11, 9 | |||
| 16, 5 | 101, 3 | 16, 5 | |||
| 16, 0 | 101, 3 | 14, 8 | |||
| 18, 5 | 101, 3 | 16, 2 | |||
| 19, 0 | 101, 3 | 12, 4 | |||
| 19, 5 | 101, 3 | 14, 6 |
Примечание: содержание молекул газа при нормальных условиях (р0 = 101, 3 кПа, Т0 = 273 К) в молярном объёме V0 – 22, 4 дм3 равно постоянной Авогадро NA = 6, 02× 1023 моль-1.
Изменение объёма в зависимости от температуры определяют по уравнению Клапейрона 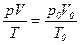
Составьте модель трансформации соединений серы в атмосфере.
|
|