
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Скорость химических реакций
|
|
1. В зависимости от физического состояния реагирующих веществ химические реакции подразделяют на:
1) экзотермические и эндотермические,
2) обратимые и необратимые,
3) каталитические и некаталитические,
4) гомогенные и гетерогенные.
2. Укажите номер или сумму условных номеров, под которыми приведены гомогенные реакции:
1) CО + O2 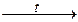
2) Zn + 2HCl ®
4) H2O + SO3(ж) ®
8) H2 + Cl2 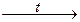
3. Укажите номер или сумму условных номеров, под которыми приведены выражения, с помощью которых можно вычислить скорость гомогенной реакции:
1) 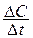 , 2)
, 2) 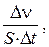 4)
4) 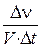 , 8)
, 8) 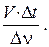
4. Единицей измерения скорости гомогенной реакции может быть:
1) моль/л·с,
2) моль/с,
3) моль/л·,
4) л/моль·с.
5. Укажите номер или сумму условных номеров, под которыми приведены справедливые выражения. В ходе гомогенной реакции
А + 2 B ® 2 C + D:
1) концентрации А и В убывают,
2) концентрация С возрастает быстрее, чем концентрация D,
4) концентрация В убывает быстрее, чем концентрация А,
8) скорость реакции остается постоянной.
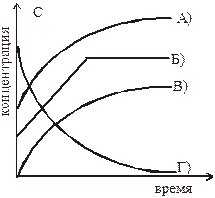
6. Под каким номером показана линия, верно отражающая изменение во времени концентрации образующегося в реакции вещества:
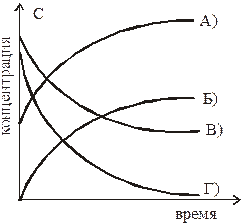
7. Изменение во времени концентрации исходного вещества в реакции, протекающей до конца, верно описывает кривая:
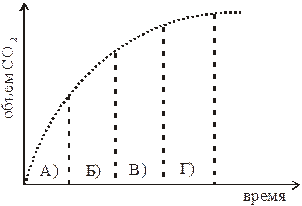
8. На графике приведено изменение во времени объема CO2, образующегося при разложении CaCO3. Под каким номером показан интервал времени (1–4), скорость разложения CaCO3 в котором наименьшая?
9. Укажите номер или сумму условных номеров, под которыми приведены реакции, скорость которых не зависит от того, по какому веществу ее вычисляют?
1) H2 + S(пары)  H2S,
H2S,
2) 3H2 + N2  2NH3,
2NH3,
4) 2H2 + O2  2H2O,
2H2O,
8) 2SO2 + O2 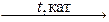 2SO3.
2SO3.
10. Укажите номер или сумму условных номеров, под которыми приведены факторы, влияющие на скорость реакции:
1) природа реагирующих веществ,
2) концентрация реагирующих веществ,
4) температура реакционной системы,
8) присутствие катализатора в реакционной системе.
11. Основной закон химической кинетики устанавливает зависимость скорости реакции от:
1) температуры реагирующих веществ,
2) концентрации реагирующих веществ,
3) природы реагирующих веществ,
4) времени протекания реакции.
12. Укажите номер или сумму условных номеров, под которыми приведены верные высказывания. Химическая кинетика:
1) раздел физики,
2) изучает скорость химической реакции,
4) использует закон действующих масс,
8) изучает зависимость скорости реакций от условий их протекания.
13. Я.Х. Вант-Гофф:
1) первый лауреат Нобелевской премии по химии,
2) изучал зависимость скорости реакции от температуры,
4) изучал зависимость скорости реакции от концентрации веществ,
8) сформулировал закон действующих масс.
14. В одинаковых условиях быстрее протекает реакция:
1) Ca + H2O ®
2) K + H2O ®
3) Mg + H2O ®
4) Zn + H2O ®
15. Скорость выделения водорода наибольшая в реакции:
1) Zn + HCl (5-процентный р–р) ®
2) Zn + НСl (10-процентный р–р) ®
3) Zn + HCl (15-процентный р–р) ®
4) Zn + HCl (30-процентный р–р) ®
16. Концентрация реагирующего вещества не влияет на скорость реакции, если это вещество в реакцию взято в:
1) твердом состоянии,
2) газообразном состоянии,
3) растворенном состоянии.
17. Вычислите среднюю скорость реакции A + B = C (моль/л× с), если известно, что исходная концентрация А составляла 0, 8 моль/л, а через 10 секунд стала 0, 6 моль/л.
1) 0, 2, 2) 0, 01, 3) 0, 1, 4) 0, 02.
18. На сколько моль/л уменьшились концентрации веществ A и B в реакции A + 2 B ® 3 C, если известно, что за это же время концентрация С увеличилась на 4, 5 моль/л?
D С А D С B
1) 1; 2,
2) 1, 5; 3,
3) 3; 1, 5,
4) 2; 1.
19. Вычислите среднюю скорость реакции 2CO + O2 ® 2CO2 (моль/л× с), если известно, что исходная концентрация CO составляла 0, 60 моль/л, а через 10 секунд стала 0, 15 моль/л. На сколько моль/л изменилась за этот промежуток времени концентрация CO2?
1) 0, 045; 0, 45,
2) 0, 045; 0, 90,
3) 0, 045; 0, 045,
4) 0, 45; 0, 45.
20. На сколько градусов нужно нагреть систему, чтобы скорость протекающей в ней реакции увеличилась в 2–4 раза?
1) 150, 2) 10, 3) 200, 4) 50.
21. Скорость реакции при 20°С равна 0, 2 моль/л× с. Определите скорость реакции при 60°C (моль/л× с), если температурный коэффициент скорости реакции равен 3.
1) 16, 2, 2) 32, 4, 3) 8, 1, 4) 4, 05.
22. Эмпирическую зависимость скорости реакции от температуры верно отражает уравнение:
1) 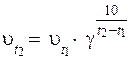 ,
,
2) 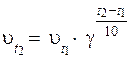 ,
,
3) 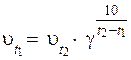 ,
,
23. Скорость реакции при 20°С равна 0, 08 моль/л× с. Вычислите скорость реакции при 0°С (моль/л× с), если температурный коэффициент скорости реакции равен 2.
1) 0, 16, 2) 0, 04, 3) 0, 02, 4) 0, 002.
24. Во сколько раз возрастет скорость реакции при повышении температуры на 40°С, если температурный коэффициент скорости реакции равен 3?
1) 64, 2) 243, 3) 81, 4) 27.
25. На сколько градусов следует повысить температуру, чтобы скорость реакции возросла в 64 раза, если температурный коэффициент скорости реакции равен 4?
1) 60, 2) 81, 3) 27, 4) 30.
26. Вычислите температурный коэффициент скорости реакции, если известно, что при повышении температуры на 50оС скорость реакции возрастает в 32 раза.
1) 3, 2) 2, 3) 4, 4) 2, 5.
27. Причиной роста скорости реакции с ростом температуры является увеличение:
1) скорости движения молекул,
2) числа столкновений между молекулами,
3) доли активных молекул,
4) стабильности молекул продуктов реакции.
28. Укажите номер или сумму условных номеров, под которыми приведены реакции, для которых MnO2 является катализатором:
1) 2KClO3 ® 2KCl + 3O2,
2) 2Al + 3I2 ® 2AlI3,
4) 2H2O2 ® 2H2O + O2,
8) 2SO2 + O2 ® 2SO3.
29. Укажите номер или сумму условных номеров, под которыми приведены правильные ответы. С помощью каталитических реакций в промышленности получают:
1) соляную кислоту,
2) серную кислоту,
4) аммиак,
8) азотную кислоту.
30. Укажите номер или сумму условных номеров, под которыми приведены правильные ответы. Катализатор:
1) участвует в реакции,
2) используется только в твердом состоянии,
4) не расходуется в ходе реакции,
8) в своем составе обязательно содержит атом металла.
31. Укажите номер или сумму условных номеров, под которыми приведены правильные ответы. В качестве катализаторов используются:
1) H2O,
2) V2O5,
4) MnO2 ,
8) Pt.
32. Вещества, уменьшающие активность катализатора, называются:
1) промоторами,
2) регенераторами,
3) ингибиторами,
4) каталитическими ядами.
33. Каталитической не является реакция:
1) (C6H10O5) n + n H2O ® n C6H12O6,
|
|