
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Следствие первое.
|
|
Энтальпия (тепловой эффект) химической реакции равна сумме энтальпий образования продуктов реакции за вычетом суммы энтальпий образования исходных веществ с учетом стехиометрических коэффициентов реакции.
Если исходные вещества и продукты реакции находятся в стандартном состоянии, то энтальпию реакции называют стандартной.
Условия считаются стандартными, если:
1) в реакции участвуют индивидуальные вещества в их наиболее устойчивых модификациях;
2) концентрации реагентов составляют 1 моль вещества на 1 кг растворителя;
3) давление соответствует 101325 Па (или 1 атм, или 760 мм рт. ст.).
4) температура соответствует 298K (или 250С).
За стандартное состояние принимается наиболее устойчивое состояние вещества (устойчивая модификация - для веществ в конденсированном состоянии; состояние идеального газа - для газов), в котором оно существует при давлении 101, 3 кПа. Стандартную термодинамическую величину обозначают верхним индексом 0, температуру указывают нижним индексом. Так, значение стандартной энтальпии реакции, измеренной при p = 101325 Па и T = 298 K обозначается:
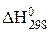
Стандартной энтальпией образования вещества называется количество теплоты, которое выделяется или поглощается при образовании одного моля этого вещества из простых веществ при стандартных условиях (Р = 101, 3 кПа, T = 298 К). Она измеряется в кДж/моль.
Теплота образования простого вещества, в наиболее устойчивой при стандартных условиях форме, принимается равной О.
Величина стандартной энтальпии реакции соответствует разности между энтальпиями исходного и конечного состояний реакции:
Δ H0 = ∑ ∆ Н кон. - ∑ ∆ Н исх.
Энтальпия конечного состояния определяются суммой стандартных энтальпий (теплот) образования веществ, получившихся в результате реакции. Энтальпия начального состояния определяется суммой стандартных энтальпий (теплот) образования веществ, вступающих в химическую реакцию.
Например, стандартная энтальпия реакции:
aA + bB = сС + dD
определяется по формуле:
Δ Н0реакции =(с∆ Н0С+ d∆ Н0D) – (a∆ Н0A+ b∆ Н0B)
где ∆ Н 0 – стандартная энтальпия образования соединения, значение которой приводится в соответствующих таблицах.
|
|