
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Тема : Квантова природа випромінювання.
|
|
Лекція №28
§ 1.Моделі атома
 Першу модель атома запропонував Томсон ≈ 1900р. За цією моделлю атом являв собою позитивно заряджену кулю радіусом≈
Першу модель атома запропонував Томсон ≈ 1900р. За цією моделлю атом являв собою позитивно заряджену кулю радіусом≈ 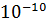 м, всередині якої знаходились нерухомі електрони.
м, всередині якої знаходились нерухомі електрони.
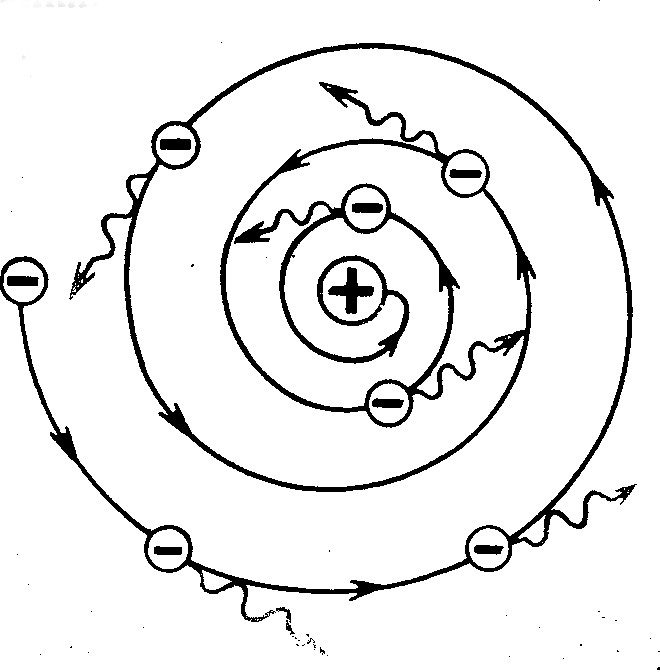
У 1911 р. Резерфорд запропонував ядерну (планетарну) модель атома. За цією моделлю атом складається з позитивно зарядженого ядра навколо якого по орбітах рухаються негативно заряджені електрони. Весь позитивний заряд і майже вся маса зосереджена в ядрі, розмір ядра ≈ 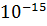 м. Ядро складається з протонв та нейтронів. Заряд ядра дорівнює суммарному заряду електронів.
м. Ядро складається з протонв та нейтронів. Заряд ядра дорівнює суммарному заряду електронів.
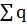 +=
+= 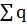 -; Np=Ne
-; Np=Ne
Недоліки
В цій моделі атом є нестійкою системою і має суцільні спектри випромінювання, хоча атом дуже стійка система і має лінійчасті спектри.
§ 2.Атом водню та його спектри
Будову атома вивчати безпосередньо не можна через його малі розміри, структура проявляється тільки посередньо в явищах випромінювання. В результаті чого було встановлено, що спектральні лінії всіх елементів можна розбити на ряд серій.
Найпростішим для вивчення є атом водню. Частоту випромінювання атома 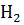 можна визначити за узагальненою формулою Бальмера: V
можна визначити за узагальненою формулою Бальмера: V 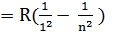
R – стала Рідберга R = 3, 29 * 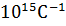
I, n– енергетичні рівні n> I
для кожної серії та кожного кожної спектральної лінії і та n набувають певних значень
1) i =1 n=2, 3, 4… 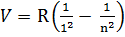 - ультрафіолетові ліні серії Лаймана
- ультрафіолетові ліні серії Лаймана
2) i=2 n=3, 4, 5… 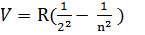 - видимі лінії серії Бальмера
- видимі лінії серії Бальмера
3) i=3 n= 4, 5, 6… 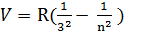 -інфрачервоні лінії серії Пашена
-інфрачервоні лінії серії Пашена
4) i=4 n= 5, 6, 7… 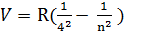 -інфрачервоні лінії серії Бреккета
-інфрачервоні лінії серії Бреккета
5) i=5 n=6, 7, 8… 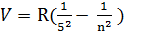 -інфрачервоні лінії серії Пфунда
-інфрачервоні лінії серії Пфунда
6) i=6n=7, 8, 9… 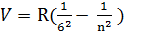 -інфрачервоні лінії серії Хемфрі
-інфрачервоні лінії серії Хемфрі
§ 3.Постулати Бора
У 1913р. Бор ввів ідеї квантової теорії в ядерну модель Резерфорда. В основі теорії лежить три постулати:
1.Постулат стаціанарних станів: В атомі є стаціонарні стани кожному з яких відповідає певне значення енергії атома.Знаходячись у стаціонарному стані атом не випромінює і не поглинає енергії.
2.Правило частот: Випромінювання і поглинання енергії атомами відбувається при їх переході з одного стаціонарного стану в інший. Енергія фотона, що випромінюється або поглинається рівна різниці енергій відповідних стаціонарних станів.hv=  -
- 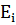
3.Правило квантування орбіт: Стаціонарними є такі стани для яких виконується співвідношення:
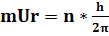 = n h
= n h
Для електрона, що рухається по колу радіус стаціонарної орбіти визначається за формулою:
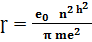
Для основного стану (n=1) значення першого борівського рідіуса = 0, 528* 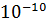 м, при n=1 атом перебуває в основному енергетичному стані, якщо n> 1? то стан атома називають збудженим енергія на будь якому енергетичному рівні визначається за формулою
м, при n=1 атом перебуває в основному енергетичному стані, якщо n> 1? то стан атома називають збудженим енергія на будь якому енергетичному рівні визначається за формулою
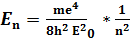
Частота хвилі фотона визначається за формулою:
 -
- 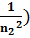
|
|