
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Способи добування ненасичених карбонових кислот
|
|
Способи добування ненасичених одноосновних карбонових кислот полягають або до утворення подвійного зв’язку, або до введення карбоксильної групи до відповідних вихідних сполук.
3. Фізичні та хімічні властивості
Ненасичені одноосновні кислоти – рідини або тверді речовини з більшою густиною, ніж відповідні насичені кислоти; нижчі – рідини зі специфічним неприємним запахом, розчинні у воді; вищі – без запаху і нерозчинні у воді.
Хімічні властивості ненасичених одноосновних карбонових кислот зумовлені наявністю карбоксильної групи й подвійного зв’язку в карбоновому ланцюгу. Для них характерні всі реакції одноосновних кислот: утворення солей, хлорангідридів, ангідридів, амідів, естерів та ін. За рахунок подвійного зв’язку вони вступають у реакції приєднання, окиснення, полімеризації.
Введення подвійного зв’язку підвищує силу кислоти. Вплив подвійного зв’язку зменшується із збільшенням віддаленості його від карбоксильної групи. Найсильніше І-ефект (індукційний) виявляється в a -, b- ненасичених кислотах. Внаслідок спряження між подвійними зв’язкоми реакції приєднання відбуваються в положенні 1, 4 – як для спряжених систем.
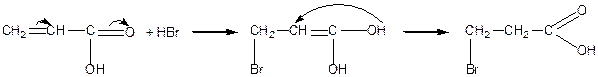
|
Приєднання відбувається всупереч правилу Марковникова. Аналогічно відбувається приєднання води, спирту, аміаку:
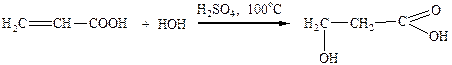
| |
| акрилова кислота |  оксипропіонова кислота оксипропіонова кислота
|
Ненасичені кислоти, як і олефіни, легко окиснюються за подвійним зв’язком:
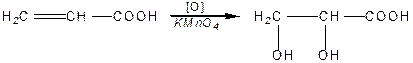
| |
| акрилова кислота | діоксипропіонова кислота |
Окиснення за жорстких умов супроводжується розривом карбонового ланцюга за місцем подвійного зв’язку:

|
| мурашина кислота щавлева кислота |
Реакції полімеризації
Ненасичені 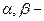 кислоти і їх естери здатні легко полімеризуватися з утворенням високомолекулярних сполук:
кислоти і їх естери здатні легко полімеризуватися з утворенням високомолекулярних сполук:
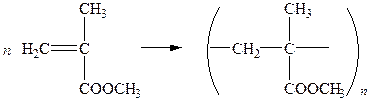
| |
| метилметакрилат | поліметилметакрилат (органічне скло) |
Високомолекулярні сполуки, утворені полімеризацією, як правило, прозорі, безбарвні, інертні до світла, розм’якшуються за температури 100°С і здатні формуватися. Із них виготовляють органічне скло, плівки, клеї, волокна.
4. Окремі представники ненасичених карбонових кислот, їх значення і використання.
Акрилова (пропенова) кислота 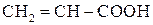 , продукти її полімеризації і полімери на основі акрилової кислоти: метиловий естер, нітрил акрилової кислоти. Метакрилова кислота (2-метилпропенова), продукти полімеризації метакрилової кислоти та її метилового ефіру. Поліакрилати. Оргскло.
, продукти її полімеризації і полімери на основі акрилової кислоти: метиловий естер, нітрил акрилової кислоти. Метакрилова кислота (2-метилпропенова), продукти полімеризації метакрилової кислоти та її метилового ефіру. Поліакрилати. Оргскло.
Сорбінова (2, 4-гексадієнова) кислота — біла кристалічна речовина, погано розчинна у воді. Вона пригнічує розвиток багатьох мікроорганізмів, особливо дріжджових грибків і має високу антимікробну дію. Зустрічається у складі речовин деяких ягід, наприклад, горобині.
Сорбінова кислота для організму нешкідлива, застосовується як консервант для попередження пліснявіння безалкогольних напоїв, плодово-ягідних соків, кондитерських виробів (мармеладу, джемів, варення, кремів), а також сирів, напівкопчених ковбас, зернистої ікри, рибних продуктів.
Олеїнова (9-октадеценова) кислота — світло-жовта масляниста рідина, нерозчинна у воді, добре розчинна в ряді органічних розчинників. Природна олеїнова кислота є 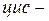 ізомером і надзвичайно розповсюджена у природі, входить до складу тригліцеридів, фосфоліпідів багатьох масел і жирів.
ізомером і надзвичайно розповсюджена у природі, входить до складу тригліцеридів, фосфоліпідів багатьох масел і жирів.
Лінолева (9, 12-октадекадеценова) і ліноленова (9, 12, 15-октадекатриєнова) кислоти ще більш ненасичені, ніж олеїнова кислота. У вигляді естерів із гліцерином — тригліцеридів зустрічаються в природних маслах. Не синтезуються організмом людини й повинні надходити з продуктами харчування — це незамінні жирні кислоти. Дослідження останніх років довели, що ненасичені жирні кислоти мають важливе значення для організму:
— вони підвищують опірність різним інфекціям;
— знижують чутливість до радіоактивного випромінювання;
— входять в сполуки з холестерином (органічна речовина, що синтезується самим організмом) і перешкоджають його відкладенню в стінках судин, попереджаючи при цьому хворобу судин атеросклероз;
— підтримуючи розумову активність, сприяють функціонуванню головного мозку і нервів.
Лекція № 14 (2 години)
ДВООСНОВНІ КАРБОНОВІ КИСЛОТИ
План лекції:
1. Класифікація, ізомерія, номенклатура двоосновних карбонових кислот.
2. Способи добування двоосновних карбонових кислот.
3. Фізичні та хімічні властивості кислот.
4. Окремі представники, їх значення і використання.
5. Ароматичні і ненасичені двоосновні кислоти: основні властивості і використання.
Ключові слова: двоосновні карбонові кислоти, етандіова кислота (щавлева), пропандіова кислота(малонова), циклічні ангідриди, декарбоксилування, оксалати, найлон, гліфталеві смоли, фенолфталеїну, лавсан.
Література: [1] с. 207 – 218; [3] с. 393 – 399
1. Класифікація, ізомерія, номенклатура двоосновних карбонових кислот
Двоосновні, або дикарбонові, кислоти містять у молекулі дві карбоксильні групи. У залежності від будови вуглеводневого залишку розрізнюють насичені, ненасичені, ароматичні двоосновні карбонові кислоти.
Структурна ізомерія насичених аліфатичних двоосновних карбонових кислот зумовлена будовою карбонового скелету, ненасичених — будовою скелету і положенням подвійних зв’язків. Для ненасичених кислот має місце геометрична 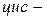
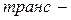 ізомерія. Ізомерія ароматичних двоосновних кислот також пов’язана зі взаємним розміщенням карбоксильних груп у бензольному ядрі (
ізомерія. Ізомерія ароматичних двоосновних кислот також пов’язана зі взаємним розміщенням карбоксильних груп у бензольному ядрі (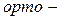 ,
, 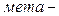 і
і  ізомери).
ізомери).
Із кислот цього ряду найбільше значення мають ті, в яких функціональні групи знаходяться в кінці нормального карбонового ланцюгу. Найпростіша кислота ряду — щавлева (етандіова) — 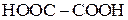 .
.
Найпоширені дикарбонові кислоти
| Формула | Назва кислоти за тривіальною номенклатурою | |
| 1. | 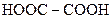
| Щавлева |
| 2. | 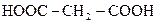
| Малонова |
| 3. | 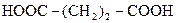
| Бурштинова (янтарна) |
| 4. | 
| Глутарова |
| 5. | 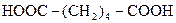
| Адипінова |
Для двоосновних кислот використовують переважно тривіальні назви. За номенклатурою IUPAC назву утворюють від назви відповідного насиченого вуглеводню (з тією ж кількістю атомів Карбону) додаванням до неї закінчення 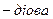 кислота (або дикарбонова). Наприклад, щавлева — етандіова, а малонова — пропандіова (або метандикарбонова) кислота.
кислота (або дикарбонова). Наприклад, щавлева — етандіова, а малонова — пропандіова (або метандикарбонова) кислота.
|
|