
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Типы молекулярных орбиталей, их классификация в зависимости от свойств симметрии.
|
|
Классификация молекулярных орбиталей, отнесение их к определённому типу – основана на качественных представлениях об их симметрии. Учёт симметрии при решении молекулярных проблем проводят на основе так называемых теоретико – групповых представлений. Центральными понятиями здесь являются симметрия, элементы симметрии и операции симметрии. В самом общем смысле под операцией симметрии понимают преобразование, которое переводит рассматриваемую систему (молекулу) из одного положения в пространстве в другое, полностью эквивалентное первому. При таком преобразовании движением электронов и ядер пренебрегают, полагая, что оно возобновляется после выполнения операций симметрии. Совокупность возможных операций симметрии определяет симметрию системы (молекулы). Под симметрией молекулы понимают её способность переходить в эквивалентное положение (совмещать саму себя с собой) под действием пространственных преобразований или операций симметрии. К операциям симметрии относят:
1. Поворот на определённый угол вокруг некоторой оси;
2. Отражение в определённой плоскости;
3. Отражение в определённой точке.
Геометрические точки, прямые и плоскости, относительно которых осуществляются операции симметрии, называются элементами симметрии. Операции симметрии данной молекулы (повороты вокруг оси, отражения в плоскости, отражения в точке) образуют группу, если под произведением элементов группы понимать последовательность применения операций симметрии. Понятия операция симметрии и элемент симметрии часто выступают как взаимозаменяемые понятия, однако именно операции симметрии являются элементами группы. Элементы симметрии молекулы (оси, плоскости) пересекаются, по крайней мере, в одной точке. Множество всех операций симметрии, при которых может оставаться неизменной одна точка, называется точечной группой симметрии. Если в молекуле есть центр симметрии, то он является такой неподвижной точкой. В квантовой химии и спектроскопии для обозначения операций симметрии используется система Шенфлиса, а в химии твёрдого тела – система Германа-Могена. Перечислим типы операций симметрии и приведём их обозначения по Шенфлису:
1. Тождественное преобразование, 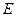
2. Собственное вращение, 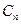
3. Отражение (зеркальное отражение), 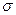
4. Инверсия, 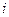
5. Несобственное вращение, 
Для собственного и несобственного вращения нижний индекс 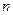 связан с углом поворота
связан с углом поворота 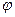 соотношением вида:
соотношением вида:
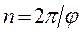
Таблица 3. Элементы симметрии и операции симметрии.
| Операции симметрии | Элементы симметрии | Комментарий |
| Тождественное преобразование | Тождественный
элемент, 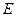
| При тождественном преобразовании молекула остаётся неизменной |
Поворот на угол 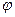 (собственное вращение)
(собственное вращение)
| Поворотная ось
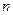 - го порядка - го порядка 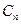 , ,

| Если молекула имеет несколько осей порядка 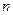 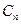 , то ось с большим значением , то ось с большим значением 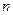 называется
главной осью. Главная ось направлена вдоль оси называется
главной осью. Главная ось направлена вдоль оси 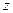
|
| Отражение в вертикальной плоскости | Вертикальная
плоскость, 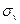
| Вертикальная плоскость 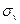 проходит через главную ось
проходит через главную ось 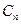
|
| Отражение в горизонтальной плоскости | Горизонтальная
плоскость, 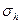
| Горизонтальная плоскость 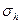 перпендикулярна главной оси перпендикулярна главной оси 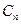
|
| Отражение в диагональной плоскости | Диагональная
плоскость, 
| Диагональная плоскость  проходит через главную ось проходит через главную ось 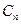 и делит пополам угол между двумя осями второго порядка и делит пополам угол между двумя осями второго порядка 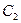 , перпендикулярными главной оси , перпендикулярными главной оси 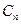
|
| Инверсия (отражение в центре симметрии) | Центр симметрии
(инверсии), 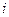
| Инверсия переставляет атомы так же, как и поворот вокруг оси второго порядка 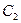
|
| Несобственное врашение | Зеркально –
поворотная ось,  здесь
здесь 
| Операция  включает в себя поворот на угол включает в себя поворот на угол 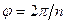 и последующее отражение в плоскости, перпендикулярной
оси вращения и последующее отражение в плоскости, перпендикулярной
оси вращения
|
Молекулярные орбитали классифицируют как симметричные и антисимметричные относительно определённых операций симметрии данной точечной группы молекулы. Если данная операция симметрии совмещает молекулярную орбиталь саму с собой, то орбиталь называется симметричной. Если при выполнении данной операции симметрии орбиталь изменяет свой знак на противоположный, то она называется антисимметричной. Классификацию молекулярных орбиталей по симметрии проводят относительно поворота на 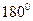 вокруг молекулярной оси
вокруг молекулярной оси 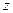 , отражения в плоскости
, отражения в плоскости 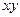 и инверсии. Так,
и инверсии. Так, 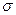 - орбиталь является симметричной относительно поворота на угол
- орбиталь является симметричной относительно поворота на угол 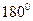 вокруг молекулярной оси
вокруг молекулярной оси 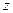 , в то время как
, в то время как 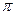 - орбиталь напротив, антисимметрична относительно такого рода преобразования. Связывающая молекулярная орбиталь симметрична относительно отражения в плоскости
- орбиталь напротив, антисимметрична относительно такого рода преобразования. Связывающая молекулярная орбиталь симметрична относительно отражения в плоскости 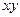 , а разрыхляющая – антисимметрична. Разрыхляющие молекулярные орбитали обозначают верхним индексом
, а разрыхляющая – антисимметрична. Разрыхляющие молекулярные орбитали обозначают верхним индексом 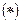 справа от символа орбитали
справа от символа орбитали 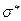 ,
, 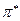 .
.
Если при инверсии знак образующейся молекулярной орбитали не изменяется, то такая молекулярная орбиталь называется «чётной» (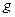 , «gerade» - чётная), если же знак молекулярной орбитали при инверсии изменяется на противоположный, то такая молекулярная орбиталь называется «нечётной» (
, «gerade» - чётная), если же знак молекулярной орбитали при инверсии изменяется на противоположный, то такая молекулярная орбиталь называется «нечётной» (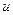 , «ungerade» - нечётная). Чётные молекулярные орбитали обозначаются нижним индексом
, «ungerade» - нечётная). Чётные молекулярные орбитали обозначаются нижним индексом 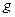 справа от символа орбитали, а нечётные – индексом
справа от символа орбитали, а нечётные – индексом 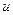 (
(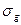 ,
, 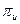 ). Важно отметить, что не каждое перекрывание атомных орбиталей приводит к образованию молекулярной орбитали. Чтобы перекрывание было эффективным, соответствующие базисные атомные орбитали должны обладать одинаковыми свойствами симметрии относительно молекулярной оси
). Важно отметить, что не каждое перекрывание атомных орбиталей приводит к образованию молекулярной орбитали. Чтобы перекрывание было эффективным, соответствующие базисные атомные орбитали должны обладать одинаковыми свойствами симметрии относительно молекулярной оси 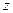 . Это утверждение является следствием теоремы Вигнера, называемого также принципом симметрии. Если же такое эффективное перекрывание исходных (базисных) атомных орбиталей отсутствует в силу различных свойств симметрии последних, то образуется несвязывающая молекулярная орбиталь. Нахождение электрона такой молекулярной орбитали не приводит к понижению полной энергии системы по сравнению с энергией составных частей. Очевидно, тип образующейся молекулярной орбитали будет определяться типом соответствующих исходных (базисных) атомных орбиталей из которых будет состоять последняя и в которые она будет переходить при увеличении межъядерного расстояния
. Это утверждение является следствием теоремы Вигнера, называемого также принципом симметрии. Если же такое эффективное перекрывание исходных (базисных) атомных орбиталей отсутствует в силу различных свойств симметрии последних, то образуется несвязывающая молекулярная орбиталь. Нахождение электрона такой молекулярной орбитали не приводит к понижению полной энергии системы по сравнению с энергией составных частей. Очевидно, тип образующейся молекулярной орбитали будет определяться типом соответствующих исходных (базисных) атомных орбиталей из которых будет состоять последняя и в которые она будет переходить при увеличении межъядерного расстояния 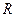 , т.е. при условии, когда
, т.е. при условии, когда  (состояние разъединённых атомов). При условии, когда
(состояние разъединённых атомов). При условии, когда 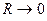 , возникает состояние объединённого атома. Диаграмма, которая показывает, в какие состояния объединённого и разъединённого атомов переходит данная молекулярная орбиталь при изменении межъядерного расстояния, называется корреляционной диаграммой, которая называется также диаграммой соответствия.
, возникает состояние объединённого атома. Диаграмма, которая показывает, в какие состояния объединённого и разъединённого атомов переходит данная молекулярная орбиталь при изменении межъядерного расстояния, называется корреляционной диаграммой, которая называется также диаграммой соответствия.
|
|