
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Гібридизація зв'язків.
|
|
Водневий зв'язок. Зв'язок виникаючий між електронегативними атомами, який містить одну вільну електронну пару (О, N, S) та ковалентну зв'язаним атомам водню, який володіє підвищеною рухомістю називається водневий зв'язок.
Гібридизація орбіталей. Не в збудженому атомі вуглецю (1s22s22px2py) на
першому електронному рівні знаходяться два спарених електрони (1s2), а на другому електронному рівні - два спарених електрона на 2s - орбіталі (2s) і по одному неспареному електронах на двох р-орбіталях (px і py), а одна р-орбіталь залишається
вільною (pz). У такому стані вуглець повинен бути двух- валентним. Однак добре відомо, що у подавленій більшості сполук вуглець чотирьохвалентний і що усі чотири зв'язки у такого роду симетричних структурах (СХ4) однакові.
Суть цього поняття заключається у тому, що близькі по енергії ті маючі загальний елемент симетрії молекулярні оробіталі можуть взаємодіяти між собою, утворюючи так називаємі гібридні орбіталі з більш низькою енергією.
Так, при взаємодії s-орбіталі з px орбіталью утворюються sp-гібридизовані
орбіталі, наприклад, у атомів вуглецю ацетилену та ориєнтировані по осі %. Такий тип гібридизації називається sp-гібридизація.
Електронегативність атому вуглецю, дорівнює 2, 5; характеризує атоми вуглецю у степені гібридизації sp.
Фізична природа ковалентного зв'язку. Атомні орбіталі. Зоммерфільд ввів друге квантове число і - азимутальне квантове число та предполагає, що електрони можуть знаходитись не тільки на кругових, но і на еліпсових орбіталях. При головному квантовому числі n друге квантове число і могло прийняти значення від 0 до n-1. Кожному значенню і відповідала якась форма електронної орбіталі, яка позначалась як s (при і = 0), р (при і = 1), d (при і = 2) і т. п.
Хвильове рівняння Шредингера. Якщо позначити рішення хвильового рівняння Шредингера через V|/ (х, y, z) та назвати його хвильову функцією, то 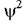 (х, y, z) виходить пропорціональним р (х, y, z). Підібрав відповідний постійний числовий множник, можна получити
(х, y, z) виходить пропорціональним р (х, y, z). Підібрав відповідний постійний числовий множник, можна получити
при цьому хвильова функція залишитьсявизначенням рівняння Шредингера.
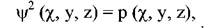
При рішенні хвильового рівняння Шредингера 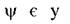 де яких областях
де яких областях
позитивна, а у де яких негативна. Оскільки імовірність має суть лише у межах позитивного значення від 0 до 1, то у загалі використовують величину 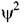 , а не просто
, а не просто 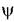 , коли хочуть пов'язати хвильову функцію з поняттям густини можливості.
, коли хочуть пов'язати хвильову функцію з поняттям густини можливості.
1. Що є предметом органічної хімії?
2. Дайте коротку характеристику головних періодів розвитку органічної хімії.
3. Яке значення має органічна хімія для народного господарства.
4. У чому полягає суть теорії хімічної будови органічних речовин? Викладіть коротко її основні положення і висновки.
5. Що таке ковалентний зв’язок і які його особливості? Наведіть приклади.
|
|