
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
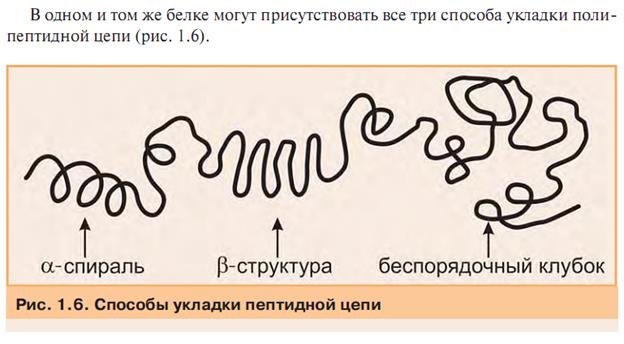
Так же беспорядочным клубком называют денатурированный белок.
|
|
4 типа белков по содержанию Альфа и Бетта-структур во вторичной структуре:
1.Только Альфа-спираль.
2.Альфа и Бетта-структуры.
3.Только Бетта-спираль.
4.Имеющие незначительные кол-во регулярные вторичные структуры.
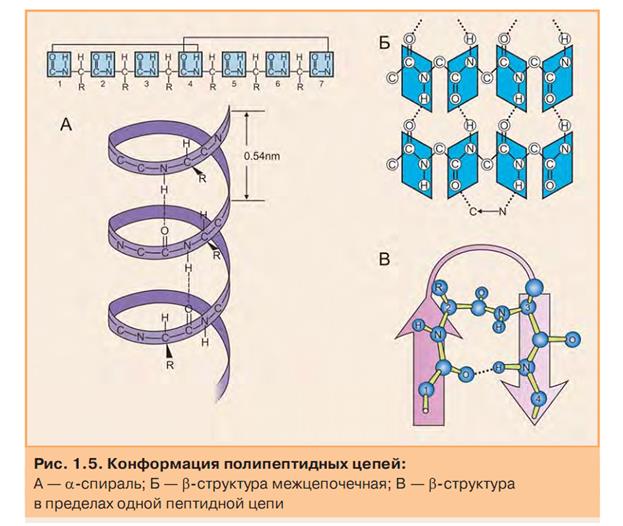
Супервторичная структура белка - это сходные сочетания элементов вторичной структуры, которые формируются за счет межрадикальных взаимодействий.
Виды межрадикальных взаимодействий:
1.Типа Бета-бочонка.
2.Альфа-спираль-поворот-Альфа-спираль. (чаще ДНК-связующие белки)
3.Цинковый палец (ДНК-связующие белки)
4.Лейциновая застежка- молния (при соединении нескольких полипептидных цепей. Гистонов например.)
Третичная структура (трехмерная структура) -способ укладки в пространстве вторичной структуры (альфа, бета, и беспорядочной структур).
Третичная структура сохраняет свою форму благодаря взаимодействию боковых аминокислотных радикалов (R), которые могут располагаться на значительном расстоянии друг от друга.
Полипептидная цепь стремится принять положение наименьшей свободной энергии. Поэтому гидрофобные радикалы аминокислот объединяются внутри глобулярной структуры растворимого в воде белка, с помощью гидрофобного взаимодействия. У нерастворимых белков все- наоборот.
Гидрофильные структуры пептидного остова, при образовании вторичной структуры, связываются между собой водородными связями, что исключает их связь с водой.
Гидрофильные радикалы аминокислот стремятся связаться с водой и поэтому находятся снаружи.
Если гидрофильные радикалы оказываются внутри гидрофобного ядра. То они связываются друг с другом ионными (аспаргин (-), глутамин (-), лизин (+), аргинин (+), гистидин (+)) или водородными (OH-, -CONH2, SH и любые гидрофильные группы).
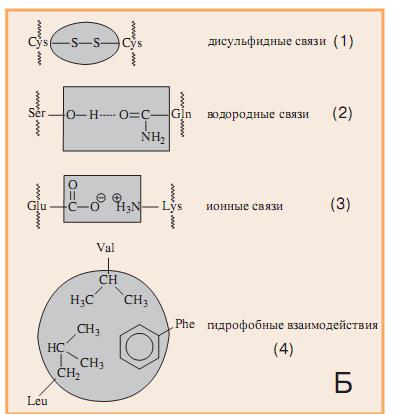
Связи между радикалами, в основном носят нековалентный характер:
1.Ионные связи между радикалами.
2.Водородные связи между полярными (водородными) радикалами.
3.Гидрофобные взаимодействия между неполярными радикалами.
4.Дисульфидные связи между радикалами двух молекул цистеина.
Конформационная лабильность белков - склонность белков к небольшим изменениям конформации за счет разрыва одних и образования других слабых связей.
Третичная структура белка так же определяется первичной структурой полипептидной цепи.
Четвертичная структура белка:
Олигомеры -белки, состоящие из нескольких субъединиц (протомеров), объединенных слабыми химическими связями. (гидрофобные, ионные, водородные)
Если несколько полипептидных цепей соединено ковоалентной связью -это все равно мономер!
|
|