
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Оксихинолин; 8-гидроксихинолин; хинофенол; оксин
|
|
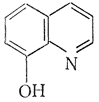
Применяется в аналитической химии. Исходный продукт производства фунгицидов и антисептиков (ятрен, хинозол, виоформ).
Получается щелочным плавлением 8-хинолинсульфокислоты, а также из о -аминофенола и глицерина в присутствии H2SO4.
Физические и химические свойства. Светло-желтые кристаллы. Т. плавл. 75—76°, т. кип. 266, 6 (752 мм рт. ст.). Трудно растворим в воде. Летуч с парами воды. Окрашивает водный раствор хлорного железа в зеленый цвет. Окисляется в хинолиновую кислоту. С металлами образует хелаты.
Токсическое действие. Животные. По данным острых опытов, токсичность для животных падает в ряду: мыши, крысы, кошки, морские свинки, кролики. При введении во влагалище мышам 1 % раствора (в полиэтиленгликоле) 2 раза в неделю по 0, 1 мл у 7 животных из 10 через 12—18 месяцев развился рак шейки матки и влагалища. Введение в желудок вызывало у грызунов рак мочевого пузыря (Bouland et al.; Falk et al.).
Некоторые производные 8-оксихинолина применяют в качестве фунгицидов [например, медную соль (C9H6ON)2Cu] и антисептиков амёбоцидного и наружного действия (например, хинозол, энтеросептол, ятрен)
Ароматические представители диазинов: пиримидин, пиразин, пиридазин.Пиримидин и его гидрокси- и аминопроизводные: урацил, тимин, цитозин – компоненты нуклеозидов. Лактим-лактамная таутомерия нуклеиновых оснований.
Пиримидин — бесцветные кристаллы с характерным запахом. Молекулярная масса пиримидина 80, 09 г/моль. Пиримидин проявляет свойства слабого двукислотного основания, так как атомы азота могут присоединять протоны за счет донорно-акцепторной связи, приобретая при этом положительный заряд.
Реакционная способность в реакциях электрофильного замещения у пиримидина снижена из-за снижения электронной плотности в положениях 2, 4, 6, вызванного наличием двух атомов азота в цикле. Так, пиримидин ненитруется и не сульфируется, однако в виде соли бромируется в положение 5.
Электрофильное замещение становится возможным только при наличии электронодонорных заместителей и направляется в наименее дезактивированное положение 5.
Под действием алкилирующих агентов (алкилгалогениды, борфторид триэтилоксония) пиримидин образует четвертичные N-пиридиниевые соли, при действии перекиси водорода и надкислот образует N-оксид.
Реакции пиридина с азотными нуклеофилами зачастую сопровождаются раскрытием кольца с дальнейшей рециклизацией: так, в жестких условиях при взаимодействии с гидразином, пиримидин образует пиразол, при взаимодействии с метиламином — 3-этил-5-метилпиридин. 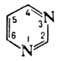
ПИРАЗИН, мол. м. 80, 1; бесцв. кристаллы. Хорошо раств. в воде. хуже - в этаноле. диэтиловом эфире. Молекула плоская; длины связей С—С и С—H близки к таковым в бензоле. длина связи С—N 0, 134 нм. пиразин -гетероароматич. соединение. Вступает в реакции электроф. и нуклеоф. замещения..Оксиды легко вступают в реакции электроф. замещения и используются для синтеза разл. производных пиразин Так, действием POCl3 на пиразин-1-оксид получают 2-хлорпиразин-1-оксид, который при взаимод. с разб. раствором NaOH превращ. в 2-гидроксипиразин-1-оксид; N-оксидная группа легко удаляется восстановлением. 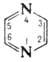
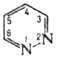
ПИРИДАЗИН (1, 2-диазин, ойазин), мол. м. 80, 09; бесцз. жидкость. Раств. в воде. спиртах. бе.золе. диэтиловом эфире. не раств. в петролейном эфире. Производные: гидрохлорид, т. пл. 161-1630C; пикрат. т. пл. 170-1750C (с разл.); комплекс с PtCl4, т. пл. 1800C. Молекула пиридазин плоская.
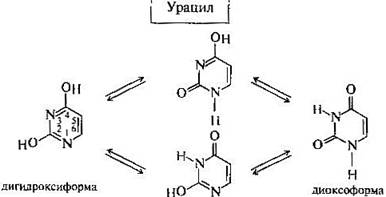
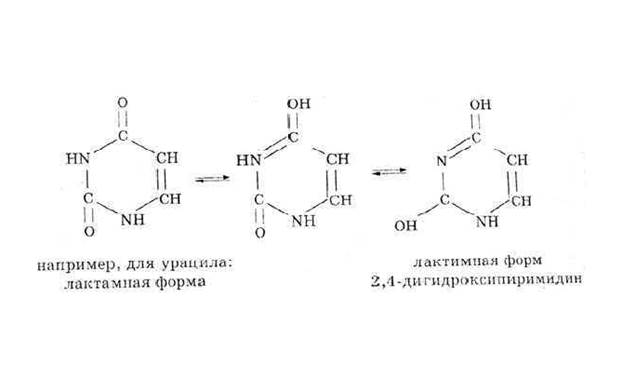
Урацил (2, 4-диоксопиримидин) — пиримидиновое основание, которое является компонентом рибонуклеиновых кислот и как правило отсутствует в дезоксирибонуклеиновых кислотах, входит в состав нуклеотида. В составе нуклеиновых кислот может комплементарно связываться с аденином, образуя две водородных связи. Белый порошок или иглоподобные кристаллы, растворимые в горячей воде. Обладает амфотерными свойствами, способен к таутомерии.[3]
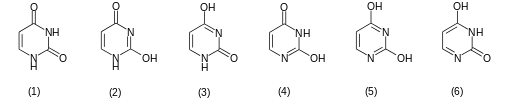
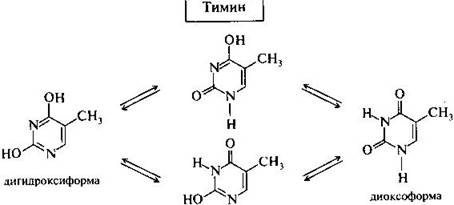
Тимин (5-метилурацил) — производное пиримидина, одно из пяти азотистых оснований. Присутствует во всех живых организмах, где вместе с дезоксирибозой входит в состав нуклеозида тимидина, который можетфосфорилироваться 1—3 остатками фосфорной кислоты с образованием нуклеотидов тимидин моно-, ди- или трифосфорной кислоты (ТМФ, ТДФ и ТТФ). Дезоксирибонуклеотиды тимина входят в состав ДНК, в РНК на его месте располагается рибонуклеотид урацила. Тимин комплементарен аденину, образуя с ним 2 водородные связи. Тиминовые основания часто окисляются до гидантоинов с течением времени после смерти организма.
Цитозин — азотистое основание, производное пиримидина. С рибозой образует нуклеозид цитидин, входит в состав нуклеотидов ДНК и РНК. Во время репликации и транскрипции по принципу комплементарности образует три водородных связи с гуанином. Бесцветные кристаллы. Раствор цитозина поглощает ультрафиолетовый свет: максимум абсорбции (λ макс) 276 ммк (pH 1-3), 267 ммк (pH 7-10), 282 ммк (pH 14). Цитозин, химическая формула C4H5N3O, проявляет основные свойства, реагирует с щелочами и кислотами, реагируя с азотистой кислотой дезаминируется, превращаясь в урацил. Растворим в воде, слабо растворим в эфире, не растворим в спирте. При взаимодействии раствора цитозина с диазобензолсульфокислотой в щелочной среде, раствор окрашивается в синий цвет.
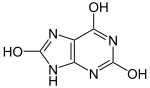
Таутомерия - это равновесная динамическая изомерия. Сущность ее заключается во взаимном превращении изомеров с переносом какой-либо подвижной группы и соответствующем перераспределении электронной плотности.
Лактамная форма (оксоформа или NH-форма) более термодинамически устойчива, чем лактимная.
Кислородные производные азотсодержащих гетероциклов в зависимости от условий могут существовать в различных таутомерных формах, переходящих друг в друга благодаря лактим-лактамной таутомерии.
Пурин: ароматичность. Гидрокси- и аминопроизводные пурина: гипоксантин, ксантин, мочевая кислота, аденин, гуанин. Лактим-лактамная таутомерия. Кислотные свойства мочевой кислоты, её соли (ураты). Метилированные ксантины: кофеин, теофиллин, теобромин.
Пурин — простейший представитель имидазо[4, 5-d]пиримидинов. Бесцветные кристаллы, хорошо растворимые в воде, горячем этаноле и бензоле, плохо растворимые в диэтиловом эфире, ацетоне и хлороформе. Пурин проявляет амфотерные свойства (рКа 2, 39 и 9, 93), образуя соли с сильными минеральными кислотами и металлами (замещается водород имидазольного цикла).
Для пурина характерна прототропная таутомерия по имидазольному атому водорода, в водных растворах втаутомерном равновесии присутствует смесь 7H- и 9H-таутомеров:
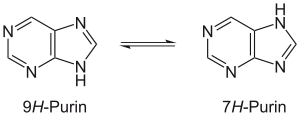
Ацилирование и алкилирование пурина идет по имидазольным атомам азота. Так, при ацилировании уксусным ангидридом образуется смесь 7- и 9-ацетилпуринов, при алкилировании метилйодидом серебряной соли пурина либо диметилсульфатом в щелочных условиях образуется 9-метилпурин, действие избытка йодистого метила в диметилформамиде ведет к кватернизации с образованием йодида 7, 9-диметилпуриния.
Пурин — электрондефицитная гетероциклическая система, поэтому реакции электрофильного замещения для него нехарактерны. При действии пероксида водорода, подобно пиридину, образует N-оксиды (смесь 1- и 3-оксидов при действии H2O2 в уксусном ангидриде).
Гипоксантин (англ. hypoxanthine) — природное производное азотистого основания пурина. Иногда встречается в составе нуклеиновых кислот, где присутствует в антикодоне тРНК в форме нуклеозида инозина. Имеет таутомер, носящий название 6-оксопурин Гипоксантин образуется восстановлением ксантина ферментом ксантин оксидоредуктазой.
Гипоксантин-гуанин фосфорибозилтрансфераза превращает гипоксантин в IMP.[2]
Гипоксантин также является продуктом спонтанного дезаминирования аденина, ввиду того, что гипоксантин похож по структуре на гуанин, такое дезаминирование может привести к ошибке в транскрипции или репликации.
Ксанти́ н — пуриновое основание, обнаруживаемое во всех тканях организма. Бесцветные кристаллы, хорошо растворимые в растворах щелочей и кислот, формамиде, горячем глицерине и плохо растворимые в воде, этаноле и эфире. Для ксантина характерна лактим-лактамная таутомерия и в водных растворах он существует в таутомерном равновесии с дигидроксиформой (2, 6-дигидроксипурином) с преобладанием диоксоформы.
Имидазольный цикл ксантина нуклеофилен: ксантин галогенируется с образованием 8-галогенксантинов, азосочетание с солями диазония также идет с образованием 8-азоксантинов, которые затем могут быть восстановлены до 8-аминоксантина или гидролизованы до мочевой кислоты.
Ксантинпроявляет амфотерные свойства, протонируясь по имидазольному азоту и образуя соли с минеральными кислотами (в т.ч. хорошо кристаллизующийся перхлорат), и образуя соли с металлами, катионы которых замещают кислые атомы водорода гидроксилов дигидроксиформы (например, нерастворимую серебряную соль реактивом Толленса).
Мочевая кислота — бесцветные кристаллы, плохо растворимы в воде, этаноле, диэтиловом эфире, растворимы в растворах щелочей, горячей серной кислоте и глицерине.
Мочевая кислота была открыта Карлом Шееле (1776) в составе мочевых камней и названа им каменной кислотой — acide lithique, затем она была найдена им в моче. Название мочевой кислоты дано Фуркруа, её элементарный состав установлен Либихом.
Является двухосновной кислотой (pK1 = 5.75, pK2 = 10.3), образует кислые и средние соли — ураты.
Ураты — кислые, хорошо растворимые натриевая и калиевая соли мочевой кислоты. В организме человека могут откладываться в почках и мочевом пузырев составе камней, а также в виде подагрических отложений.
При перенасыщении организма уратами происходит их отложение в мягких тканях вместе с мочевой кислотой с образованием подагрических узелков
В водных растворах мочевая кислота существует в двух формах: лактамной (7, 9-дигидро-1H-пурин-2, 6, 8(3H)-трион) и лактимной (2, 6, 8-тригидроксипурин) с преобладанием лактамной:

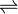
Легко алкилируется сначала по положению N-9, затем по N-3 и N-1, под действием POCl3 образует 2, 6, 8-трихлорпурин.
Азотной кислотой мочевая кислота окисляется до аллоксана, под действием перманганата калия в нейтральной и щелочной среде либо перекиси водорода из мочевой кислоты образуются сначала аллантоин, затем гидантоини парабановая кислота.
Аденин — азотистое основание, аминопроизводное пурина (6-аминопурин). Образует две водородных связи сурацилом и тимином Аденин — бесцветные кристаллы, которые плавятся при температуре 360—365 °C. Обладает характерным максимумом поглощения (λ макс) при 266 ммк (pH 7) Химическая формула С5H5N5, молекулярный вес 135, 14 г/моль. Аденин проявляет основные свойства (pKa1=4, 15; pKa2=9, 8). При взаимодействии с азотной кислотой, аденин теряет аминогруппу, превращаясь в гипоксантин (6-оксипурин). В водных растворах кристаллизуется в кристаллогидрат с тремя молекулами воды. Плохо растворим в воде, с понижением температуры воды, растворимость аденина в ней падает. Плохо растворим в спирте, в хлороформе, эфире. Растворим в кислотах и щелочах.
Гуани́ н (Гуа, Gua) — азотистое основание, аминопроизводное пурина (2-амино-6-оксопурин), является составной частью нуклеиновых кислот. В ДНК, при репликации и транскрипции образует три водородных связи с цитозином Бесцветный, аморфный кристаллический порошок. Температура плавления 365 °C. Раствор гуанина в HCl флуоресцирует. Реагирует с кислотами и щелочами с образованием солей.
При действии на гуанин HNO2 (азотистой кислоты) образуется ксантин.
Хорошо растворим в кислотах и щелочах, плохо растворим в эфире, спирте, аммиачных и нейтральных растворах, нерастворим в воде. Таутомерия - это равновесная динамическая изомерия. Сущность ее заключается во взаимном превращении изомеров с переносом какой-либо подвижной группы и соответствующем перераспределении электронной плотности.
Лактамная форма (оксоформа или NH-форма) более термодинамически устойчива, чем лактимная.
Кислородные производные азотсодержащих гетероциклов в зависимости от условий могут существовать в различных таутомерных формах, переходящих друг в друга благодаря лактим-лактамной таутомерии. 
Кофеи́ н (также матеин, гуаранин[1]) — алкалоид пуринового ряда, бесцветные горькие кристаллы. Являетсяпсихостимулятором, содержится в кофе, чае и многих прохладительных напитках. Кофеин содержится в растениях, таких как кофейное дерево, чай, какао, мате, гуарана, кола, и некоторых других. Он синтезируется растениями для защиты от насекомых, поедающих листья, стебли и зёрна, а также для поощрения опылителей.
У животных и человека он стимулирует центральную нервную систему, усиливает сердечную деятельность, ускоряет пульс, вызывает сужение кровеносных сосудов, усиливает мочеотделение. Это связано с тем, что кофеин блокирует ферментфосфодиэстеразу, разрушающий цАМФ, что приводит к его накоплению в клетках. цАМФ — вторичный медиатор, через который осуществляются эффекты различных физиологически активных веществ, прежде всего, адреналина
Белые игольчатые кристаллы горьковатого вкуса, без запаха. Хорошо растворим в хлороформе, плохо растворимв холодной воде (1: 60), легко — в горячей (1: 2), трудно растворим в этаноле (1: 50).

Теофилли́ н (от лат. Thea — чайный куст и греч. phyllon — лист) — метилксантин, производное пурина, гетероциклический алкалоид растительного происхождения 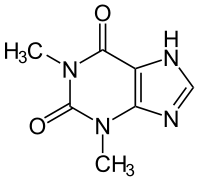
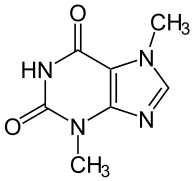
Теоброми́ н (от латинского названия какао — Theobroma cacao) — алкалоид пуринового ряда, изомерентеофиллину. Бесцветные кристаллы горького вкуса, нерастворимые в воде. Теобромин представляет белый кристаллический порошок слегка горького вкуса, ядовит, не разлагается на воздухе и при 100 °C; при 250 °C начинает чернеть и при 290—295 °C возгоняется; плавится при 329—330 °C. Нерастворим в лигроине, немного растворим в воде (1 ч. при 17 °C в 1600 ч. воды) и ещё менее в спирте, эфире, бензоле и хлороформе (при 20 °C 100 см³ абсол. спирта растворяют 0, 007 г теобромина; эфира — 0, 004 г, бензола — 0, 0015 г, хлороформа — 0, 025 г).
При обработке теобромина хлорной водой или соляной кислотой и бертолетовой солью получается метилаллоксан, метилмочевина и метилпарабановая кислота; в последнем случае — вместе с апотеобромином.Хромовая смесь, так же как и крепкая азотная кислота, выделяют из теобромина сначала амалиновую кислоту, а потом углекислоту, метиламин и метилпарабановую кислоту:
C7H8N4О2 + 3H2 О → СО 2 + 2NH2(CH3) + C4H4N2О4.
При нагревании с крепкой соляной кислотой или с баритовой водой теобромин распадается на углекислоту, аммиак, метиламин, саркозин и муравьиную кислоту:
C7H8N4О2 + 6H2О → 2СО 2 + 2NH3 + NH2(CH3) + C3H7NO2 + CH2О2.
Подвергнутый действию электрического тока теобромин даёт вещество состава C6H8N2О8 (Rochleder и Hlasiwetz).
Теобромин может быть переведён в кофеин или нагреванием до 100 °C с йодистым метилом, едким кали и спиртом, или осаждением серебряной соли теобромина йодистым метилом.
Пуриновые и пиримидиновые нуклеозиды. Строение; номенклатура. Характер связи нуклеинового основания с углеводным остатком. Нуклеотиды. Строение; номенклатура нуклеозидмонофосфатов. Нуклеозидциклофосфаты. Нуклеозидполифосфаты. Отношение к гидролизу.
НУКЛЕОЗИДЫ, прир. гликозиды, молекулы к-рых состоят из остатка пуринового или пиримидинового основания, связанного через атом N с остатком D-рибозы или 2-дезок-си-D-рибозы в фуранозной форме; в более широком смысле-прир. и синтетич. соед., в молекулах к-рых гетероцикл через атом N или С связан с любым моносахаридом, иногда сильно модифицированным (см. Минорные нуклеозиды). В зависимости от входящих в молекулу остатков моносахари-да и гетероциклич. основания различают рибо- и дезокси-рибонуклеозиды, пуриновые и пиримидиновые нуклеозиды. Канонические нуклеозиды (см.рис.)-аденозин (сокращенно А), гуанозин (G), цитидин (С), их 2'-дезоксианалоги, а также тимидин (Т) и уридин (U)-являются компонентами нуклеиновых кислот. В природе нуклеозиды встречаются также в своб. состоянии (преим. в виде нуклеозидных антибиотиков).
Нуклеозиды, содержащие в своем составе пиримидин, имеют в названииокончание - ин Нуклеозиды, содержащие в своем составе пурин, имеют в названииокончание - озин Обратите внимание на номенклатуру нуклеозидов, содержащих тимин.Тимин- основание ДНК, и если нуклеозид содержит дезоксирибозу, то в названии нуклеозида (тимидин) не требуется подчеркивать химическую природу углевода.Если тимин связан с рибозой, что представляет собой нетипичную биологическую ситуацию, то в названии указывается название углевода (тимидинрибозид или рибозид тимидина Наиболее распространенные нуклеозидыТип связи - N -β - гликозидная
| Азотистое основание | Нуклеозид углевод рибоза | Нуклеозид углевод дезоксирибоза |
| урацил | уридин | дезоксиуридин |
| цитозин | цитозин | дезоксицитозин |
| тимин | тимидинрибозид | тимидин |
| аденин | аденозин | дезоксиаденозин |
| гуанин | гуанозин | дезоксигуанозин |
| гипоксантин | инозин | дезоксиинозин |
Нуклеоти́ ды — фосфорные эфиры нуклеозидов, нуклеозидфосфаты. Свободные нуклеотиды, в частностиАТФ, цАМФ, АДФ, играют важную роль в энергетических и информационных внутриклеточных процессах, а также являются составляющими частями нуклеиновых кислот и многих коферментов.
Нуклеотиды являются сложными эфирами нуклеозидов и фосфорных кислот. Нуклеозиды, в свою очередь, являются N-гликозидами, содержащими гетероциклический фрагмент, связанный через атом азота с C-1 атомом остатка сахара.
В природе наиболее распространены нуклеотиды, являющиеся β -N-гликозидамипуринов или пиримидинов и пентоз — D-рибозы или D-2-дезоксирибозы. В зависимости от структуры пентозы различают рибонуклеотиды идезоксирибонуклеотиды, которые являются мономерами молекул сложных биологических полимеров (полинуклеотидов) — соответственно РНК или ДНК[1].
Фосфатный остаток в нуклеотидах обычно образует сложноэфирную связь с 2'-, 3'- или 5'-гидроксильными группами рибонуклеозидов, в случае 2'-дезоксинуклеозидов этерифицируются 3'- или 5'-гидроксильные группы.
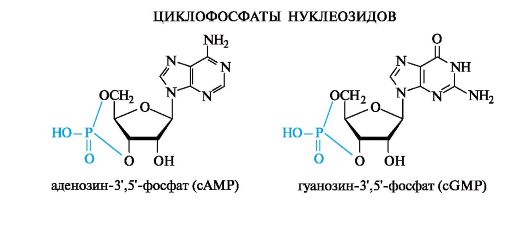
Большинство нуклеотидов являются моноэфирами ортофосфорной кислоты, однако известны и диэфиры нуклеотидов, в которых этерифицированы два гидроксильных остатка — например, циклические нуклеотиды циклоаденин- и циклогуанин монофосфаты (цАМФ и цГМФ). Наряду с нуклеотидами — эфирами ортофосфорной кислоты (монофосфатами) в природе также распространены и моно- и диэфиры пирофосфорной кислоты (дифосфаты, например, аденозиндифосфат) и моноэфиры триполифосфорной кислоты (трифосфаты, например, аденозинтрифосфат).
Соединения, состоящие из двух нуклеотидовых молекул, называются динуклеотидами, из трёх — тринуклеотидами, из небольшого числа — олигонуклеотидами, а из многих — полинуклеотидами, илинуклеиновыми кислотами.
Названия нуклеотидов представляют собой аббревиатуры в виде стандартных трёх- или четырёхбуквенных кодов.
Если аббревиатура начинается со строчной буквы «д» (англ. d), значит подразумеваетсядезоксирибонуклеотид; отсутствие буквы «д» означает рибонуклеотид. Если аббревиатура начинается со строчной буквы «ц» (англ. c), значит речь идёт о циклической форме нуклеотида (например, цАМФ).
Первая прописная буква аббревиатуры указывает на конкретное азотистое основание или группу возможных нуклеиновых оснований, вторая буква — на количество остатков фосфорной кислоты в структуре (М — моно-, Д — ди-, Т — три-), а третья прописная буква — всегда буква Ф («-фосфат»; англ. P).
Латинские и русские коды для нуклеиновых оснований:
· A — А: Аденин;
· G — Г: Гуанин;
· C — Ц: Цитозин;
· T — Т: Тимин (5-метилурацил), не встречается в РНК, занимает место урацила в ДНК;
· U — У: Урацил, встречается в ДНК у бактериофагов, занимает место тимина в РНК.
· К нуклеозидциклофосфатам относятся нуклеотиды, у которых одна молекула фосфорной кислоты этерифицирует одновременно две гидроксильные группы углеводного остатка. Практически во всех клетках присутствуют два нуклеозидциклофосфата - аденозин-3', 5'- циклофосфат (cAMP) и гуанозин-3', 5'-циклофосфат (cGMP). Они являются вторичными посредниками (мессенджерами) в передаче гормонального сигнала в клетку.
· 
· Нуклеозидмонофосфаты.
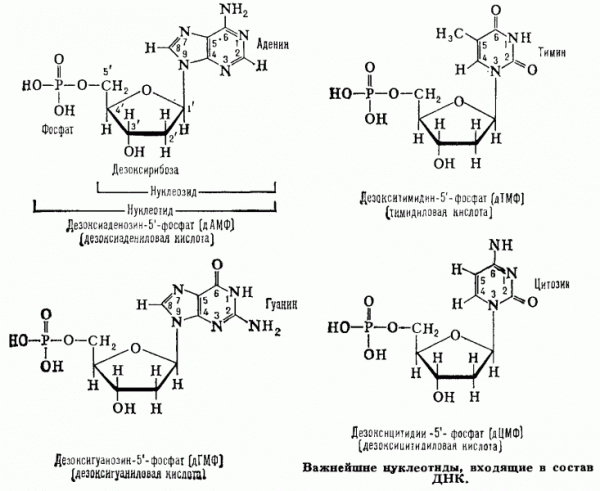
· Нуклеозидмонофосфаты содержат только один остаток фосфор-ной кислоты. Например:
· 
· Для мононуклеотидов также используют два вида названий (табл. 3.), отражающих их принадлежность как к сложным эфирам, так и к кислотам. В первом случае название включает наименование нуклеозида с указанием положения в нем фосфатного остатка: аденозин-5¢ -фосфат*, уридин-5¢ -фосфат и т. д. Широко используются и тривиальные названия, имеющие окончание «-овая кислота», например, 5¢ -Уридиловая кислота.
· Для удобства введены сокращения: трехбуквенные - АМФ (лат. AMP), УМФ (лат. UMP) и т.д. и однобуквенные - pA, pU и т.д. В биохимической литературе встречаются как русские, так и латинские обозначения, однако более широко используются латинские. Сокращения AMP, GMF и т.д. всегда относятся к 5¢ -нуклеотидам. У других, например, 3¢ -производных в сокращенном названии указывается положение фосфатной группы: 3¢ -AMP, 3¢ -GMP и т. д.
· * вместо «монофосфат» часто пишут просто «фосфат».
· В однобуквенных кодах 5¢ -фосфаты записываются с добавлением латинской буквы «p» перед символом нуклеозида (pA), 3¢ -фосфаты - после символа нуклеозида (Ap).
· Таблица 3. Важнейшие нуклеотиды, входящие в состав нуклеино-вых кислот.
| Названия нуклеотидов | Сокращенные названия | ||
| как монофосфата | как кислоты | ||
| Входящие в состав РНК | |||
| Аденозин-5¢ -фосфат* | 5¢ -Адениловая кислота | AMP | pA |
| Гуанозин-5¢ -фосфат | 5¢ -Гуаниловая кислота | GMP | pG |
| Цитидин-5¢ -фосфат | 5¢ -Цитидиловая кислота | CMP | pC |
| Уридин-5¢ -фосфат | 5¢ -Уридиловая кислота | UMP | pU |
| Входящие в состав ДНК | |||
| Дезоксиаденозин-5¢ -фосфат | 5¢ -Дезоксиадениловая кислота | dAMP | pdA |
| Дезоксигуанозин-5¢ -фосфат | 5¢ -Дезоксигуаниловая кислота | dGMP | pdG |
| Дезоксицитидин-5¢ -фосфат | 5¢ -Дезоксицитидиловая кислота | dCMP | pdC |
| Тимидин-5¢ -фосфат | Тимидиловая кислота | dTMP | pdT |
· Сложноэфирные связи с фосфатными остатками в мононуклео-тидах относительно устойчивы к кислотному гидролизу. Од
|
|