
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Гіппократ 3 страница
|
|
2.6.4. Визначення міоглобіну в сечі
Принцип методу. Суть методу полягає в осадженні міоглобіну амонію сульфатом і властивості міоглобіну набувати червоно-коричневого забарвлення.
Реактив: амонію сульфат кристалічний.
Хід визначення. У 5 мл сечі розчиняють 2, 8 г амонію сульфату, суміш фільтрують. Якщо фільтрат набуває червоно-коричневого забарвлення, це означає, що в сечі є міоглобін, а якщо фільтрат не змінює забарвлення, то в сечі – гемоглобін.
Сеча здорових тварин не містить міоглобіну. Наявність міоглобіну в сечі спостерігається при паралітичній міоглобінурії і травмах м’язів.
визначення вмісту гемоглобіну в сечі
Кількість гемоглобіну в сечі визначається геміглобінціанідним та колориметричним (за Салі) методами і експрес-набором Нерta-Phan (Lа-Chemа, Чехія).
2.6.5. Визначення вмісту гемоглобіну
в сечі методом Салі
Принцип методу. гемоглобін крові в розчині соляної кислоти перетворюється в солянокислий гематин, який порівнюється з гематином визначеної концентрації, взятої як стандарт.
Обладнання: гемометр Салі, очні піпетки, скляні палички, капіляр на 20 мкм.
Реактиви: 0, 1 N-ний розчин соляної кислоти.
Хід визначення. У середню пробірку (до мітки 2) очною піпеткою наливають 0, 1 N-ний розчин HCl. Капіляром набирають 20 мкл (0, 02 мл) сечі, кінчик його витирають ватою і сечу обережно видувають на дно пробірки, а верхнім шаром кислоти промивають капіляр. Обережно перемішують і залишають на 5 хв. Внаслідок гемолізу еритроцитів із гемоглобіну утворюється солянокислий гематин коричневого кольору. У пробірку добавляють по краплях дистильовану воду, перемішуючи вміст пробірки скляною паличкою до тих пір, поки колір у ній не порівняється з кольором стандартів. Кількість гемоглобіну у грамах на 100 мл визначають за нижнім меніском рідини. У міжнародній системі (SI)
кількість гемоглобіну визначають у грамах на 1 літр, тому одержаний результат необхідно помножити на 10.
2.6.6. Визначення вмісту гемоглобіну
геміглобінціанідним методом
Принцип методу. Гемоглобін при взаємодії з калієм залізосинєродистим (червона кров’яна сіль) окиснюється у метгемоглобін, що утворює з ацетонціангідрином кольоровий геміглобінціанід, інтенсивність забарв-лення якого пропорційна концентрації гемоглобіну.
Обладнання: фотоелектроколориметр, піпетки мірні на 0, 02 мл і
5 мл; пробірки; колби мірні на 250 мл та 1л.
Реактиви: ацетонціангідрин (2 ампули по 0, 5 мл – 0, 47 г); суміш реактивів (2 флакони по 1, 2 г), у т. ч. калій залізосинєродистий – 0, 2 г, натрій двовуглекислий – 1, 0 г; стандартний розчин гемоглобінціаніду (зберігається у холодильнику при +4 °С).
Хід визначення. До 5 мл робочого розчину в пробірку додають 0, 02 мл сечі і перемішують. Через 10 хвилин записують показники фотоелек-троколориметра при довжині хвилі 540 нм (зелений світлофільтр) у кюветі шириною 10 мм проти контрольної проби (робочий розчин або дистильована вода). За формулою або калібрувальним графіком визначають уміст гемоглобіну в сечі (г/100 мл або г/л):
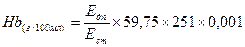 ,
,
де Едп – екстинція дослідної проби; Ест – екстинція стандартного розчину; 59, 75 – концентрація геміглобінціаніду в стандартному розчині; 251 – розведення сечі; 0, 001 – коефіцієнт для перерахунку мг/100 мл у г/100 мл.
Діагностичне значення визначення
пігментів крові
Гематурія буває справжньою, якщо вона виникає в результаті ураження органів сечової системи, і несправжньою, коли є наслідком домішування крові із статевих органів. Справжня гематурія буває нирковою, позанирковою та змішаною. Ниркова гематурія спостерігається при гострому гломерулонефриті, загостренні хронічного перебігу гломерулонефриту, при сибірці, чумі свиней, тяжкому перебігу С- і К-гіповіта-мінозів, деяких інтоксикаціях, при застійній нирці у хворих із недостатністю серця, злоякісній пухлині і травмах нирок.
Позаниркова гематурія виникає при запаленні та травмах сечовивідних шляхів і сечового міхура, сечокам’яній хворобі, гострому пієліті, злоякісних пухлинах сечового міхура, хронічній гематурії великої рогатої худоби, яка є, по суті, хронічним запаленням сечового міхура. Це захворювання характеризується кровотечею в порожнину міхура з ерозій, виразок або папіломатозних утворень на його слизовій оболонці.
Кров у сечі є давно відомим симптомом. Ще Гіппократ стверджував, що цей симптом є свідченням ураження нирок або сечового міхура. У зв’язку з цим виникає необхідність диференціації причин гематурії.
Ниркову та позаниркову гематурію диференціюють, передусім, так званою “пробою трьох склянок”. При кровотечі з уретри кров виявляють лише на початку сечовиділення (перша посудина), при ураженні сечового міхура – у кінці його (третя посудина), а при ураженні нирок – у всіх трьох посудинах. Крім того, безсумнівним доказом ниркового походження гематурії є наявність в осаді сечі еритроцитарних циліндрів, які є зліпками канальців. Звертають також увагу на співвідношення кількості еритроцитів і білка в сечі. Якщо еритроцитів у сечі міститься мало (10–20 в полі зору), а білка – понад 1 г/л, то гематурія є нирковою. І навпаки, значна кількість еритроцитів у сечі (50–100 і більше в полі зору) в поєднанні з відсутністю еритроцитарних циліндрів і кількістю білка менше 1 г/л є показником позаниркової гематурії.
Виділення із сечею гемоглобіну називають гемоглобінурією. Вона буває первинною і вторинною. Первинна гемоглобінурія є наслідком масового гемолізу еритроцитів у кров’яному руслі, коли гемоглобін, що звільняється, не встигає повністю перетворитися в білірубін. Вторинна гемоглобінурія зумовлена виходом гемоглобіну з еритроцитів уже в сечі при їх розпаді. Первинна гемоглобінурія є важливим симптомом гемолітичної хвороби поросят, післяпологової гемоглобінурії корів, пароксизмальної гемоглобінурії телят, лептоспірозу, кровопаразитарних хвороб (бабезіоз, нуталіоз, піроплазмідоз) та деяких інтоксикацій. Сеча при гемоглобінурії набуває буро-червоного кольору.
При виділенні міоглобіну (міоглобінурія) сеча має червоний або
темно-коричневий колір. Міоглобінурія спостерігається при травмах м’язів, міопатозі та паралітичній міоглобінурії коней.
2.7. Визначення продуктів
залишкового азоту в сечі
2.7.1. визначення залишкового азоту в сечі
колориметричним методом із реактивом Неслера
принцип методу. Метод складається з двох етапів: а) спалювання органічних речовин сечі концентрованою сірчаною кислотою (азот у вигляді аміа-ку зв’язується сірчаною кислотою з утворенням амонію сірчанокислого);
б) колориметричного визначення кількості аміаку, зв’язаного реактивом Неслера; при взаємодії його з амонію сульфатом інтенсивність бурувато-жовтого забарвлення залежить від кількості аміаку й, відповідно, азоту в сечі.
Обладнання. Електроплитка з асбестовою сіткою, КФК, колби Кьєльдаля, мірні циліндри на 25 мл.
Реактиви: 1) концентрована сірчана кислота; 2) водню перекис;
3) реактив Неслера; 4) стандартний розчин амонію сульфату.
Хід визначення. 1. Окиснення за методом Кьєльдаля. У колбу Кьєльдаля вносять 1 мл розведеної в 10 разів сечі, додають 1 мл концентрованої сірчаної кислоти. Паралельно готують контрольну пробу з дистильованою водою. Обидві колби 40 хв кип’ятять під витяжкою на асбестовій сітці, потім додають по 1–2 краплі водню перекису і продовжують спалювання до знебарвлювання вмісту колб. Після охолодження в колби додають по 3 мл дистильованої води і їх вміст зливають у мірні цилін-дри. Колби два рази змивають дистильованою водою (по 3 мл), збираючи змиви у відповідні мірні циліндри. Потім об’єм рідини в мірних циліндрах доводять до 10 мл і ретельно перемішують скляною паличкою. Так отримують мінералізовану сечу, розведену в 100 разів.
2. Колориметрування. Піпеткою із кожного мірного циліндра відбирають по 1 мл мінералізату і переносять у два інших мірних циліндри об’ємом 25 мл, додають по 13 мл дистильованої води і 1 мл реактиву Неслера. В дослідній пробі з’являється жовто-оранжеве забарвлення, оптична щільність якого визначається на КФК при довжині хвилі 430–460 нм у кюветі з робочою товщиною 10 мм проти контрольної проби.
3. Побудова калібрувальної кривої. Із основного стандартного розчину амонію сульфату готують серію робочих розчинів з вмістом 0, 01 мг; 0, 02; 0, 04; 0, 08; 0, 12; 0, 16 і 0, 20 мг азоту в 1 мл. до 1 мл кожного стандартного розчину в мірному циліндрі на 25 мл додають по 13 мл дистильованої води та по 1 мл реактиву Неслера і колориметрують. За показниками оптичної щільності стандартних робочих розчинів будують калібрувальну криву. Знайдений показник залишкового азоту сечі множать на 100 (ступінь розведення сечі).
Вміст загального азоту в добовій сечі (г) розраховують за формулою:

де С – вміст азоту в 1 мл розведеної сечі; В – розведення сечі (в 100 разів); Д – добовий діурез; 1000 – коефіцієнт перерахунку в грами (із мг).
Діагностичне значення визначення
залишкового азоту в сечі
Амінокислоти, які не використані для синтезу білка і утворені внас-лідок його розпаду в організмі, піддаються гідролізу з утворенням аміаку, вуглекислого газу і води. Частина аміаку виділяється з сечею у виг-ляді солей амонію, проте він використовується для синтезу сечовини в печінці, яка є основним кінцевим продуктом обміну простих білків.
Кінцевим продуктом розпаду складних білків – нуклеопротеїнів, крім сечовини, є сечова кислота.
Залишковий азот – це сума азотовмісних речовин сечі (азот сечовини, сечової кислоти, креатину, креатиніну, амінокислот, амонійних солей та ін.). відомо, що 100 г білка містить 16 г азоту. знаючи кількість азоту в сечі, можна розрахувати кількість використаного білка в організ-мі. 80–90 % азоту, який виділяється з організму, складає азот сечовини. Зміни в кількісному і якісному складі азоту сечі дають можливість робити висновки про стан білкового обміну в організмі, функціональний стан печінки, нирок, де утворюються азотисті речовини сечі. Зменшення кількості загального залишкового азоту в сечі, а також окремих його складових (сечовина, креатинін) свідчить про порушення фільтраційної здатності базальної мембрани гломерулярних капілярів, що спостерігається при нефротичному та гепаторенальному синдромах у високопродуктивних корів, а також у телят, хворих на колібактеріоз. При цьому кількість залишкового азоту в крові зростає.
2.7.2. Визначення сечовини в сечі
2.7.2.1. Визначення сечовини в сечі
(за колірною реакцією з діацетилмонооксимом)
Принцип методу. Діацетилмонооксим у кислому середовищі гідролізується до діацетилу, який, реагуючи з сечовиною, утворює комплекс червоно-рожевого забарвлення, що має максимальне поглинання при довжині хвилі 520 нм.
Обладнання: КФК-2, КФК-3, водяна баня, піпетки 0, 2; 1 і 5 мл.
Реактиви: 1) кислий реагент – 100 мл – 0, 06 %-ний розчин Н3РО4;
10 %-ний розчин Н2SО4; 0, 003 %-ний FeCl3; 2) кольоровий реагент –
50 мл – 0, 17 %-ний розчин діацетилмонооксиму (ДАМО); 0, 04 %-ний розчин тіосемікарбазиду; 3) стандарт сечовини (16, 65 ммоль/л) – 2 мл.
Використовують набір реактивів НВФ “Simko-Ltd”, м. Львів.
Хід визначення. Перед дослідженням сечу розводять дистильованою водою у співвідношенні 1׃ 10. До 0, 02 мл розведеної сечі додають 1 мл кольорового реагенту (№ 2) і 2 мл кислого реагенту (№ 1). Пробірки щільно закривають гумовими корками, які обгорнуті алюмінієвою фоль-гою, та інкубують точно 10 хв у киплячій водяній бані. Потім пробірки швидко охолоджують під струменем холодної води і не пізніше 10 хв визначають оптичну густину досліджуваних зразків і стандарту при дов-жині хвилі 490–540 нм (максимальне поглинання 520 нм) проти контролю. Аналогічно обробляють 0, 02 мл стандарту сечовини і контроль – 0, 02 мл дистильованої води. Розрахунок проводять за формулою:
Сечовина (ммоль/л) 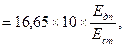
де Едп – екстинція дослідної проби; Ест – екстинція стандартного розчину; 16, 65 – концентрація сечовини в стандартному розчині, ммоль/л, 10 – коефіцієнт розведення сечі.
Примітки: 1. об’єми досліджуваних проб і реагентів можна пропорційно зменшувати чи збільшувати. Наприклад: до 0, 01 мл проби (10 мкл) додають 0, 5 мл кольорового реагенту (№ 2) і 1 мл кислого реагенту (№ 1). Обробляють, як написано вище (див. хід визначення). Як альтернативний варіант перед проведенням дослідів можна змішати
1 об’єм кольорового реагенту (№ 2) з 2-ма об’ємами кислого реагенту (№ 1) і використовувати цю суміш для проведення аналізу (0, 02 мл проби + 3 мл суміші або 0, 01 мл проби + 1, 5 мл суміші і т.д.).
2. приготування реактивів дається в посібниках: Клиническая лабораторная диагностика в ветеринарии: Справочное издание / И.П. Кондрахин, Н.В. Курилов, А.Г. Малахов и др. – М.: Агропромиздат, 1985. – С. 75–76; Методы ветеринарной клинической лабораторной диагностики: Справочник / И.П.Кондрахин, А.В. Архипов, В.И. Левченко и др.; Под ред. проф. И.П. Кондрахина. – М.: КолосС, 2004. – С. 100–101.
Стабільність досліджуваних проб. Сечовина в дослідних пробах зберігається до 8 годин при кімнатній температурі, до 72-х годин – при 2–8 °С, до 6 місяців – у замороженому стані.
2.7.2.2. Визначення сечовини в сечі
(за методом Марш)
Принцип методу. Сечовина утворює з діацетилмонооксимом у присут-ності тіосемікарбазиду і заліза у кислому середовищі комплексну сполуку, інтенсивність забарвлення якої пропорційна вмісту сечовини в сечі.
Обладнання: КФК, водяна баня, центрифуга, піпетки 0, 2; 1 і 2 мл.
Реактиви: 1) 10 %-ний розчин трихлороцтової кислоти (ТХОК), ч; 2) 2, 5 %-ний розчин діацетилмонооксиму, чда (готують змішуванням 0, 25 г реактиву і 9, 75 мл дистильованої води); 3) 0, 25 %-ний розчин тіосемикарбазиду, чда (0, 25 г реактиву розчиняють у дистильованій воді і доводять водою до 100 мл); 4) основний розчин заліза хлориду готують розчиненням 5 г заліза хлориду (хч, чда) в 100 мл дистильованої води, потім додають 1 мл концентрованої сірчаної кислоти; 5) робочий розчин заліза хлориду: 1 мл основного розчину заліза хлориду доводять до 100 мл дистильованою водою, додають 8 мл концентрованої сірчаної і 1 мл
85 %-ного розчину ортофосфорної кислоти (хч, чда). Зберігають у темному місці до 2-х тижнів; 6) кольоровий реактив (до 30 мл робочого розчину заліза хлориду додають 20 мл дистильованої води, 1 мл 2, 5 %-ного розчину діацетилмонооксиму і 0, 25 мл розчину тіосемикарбазиду).
Кольоровий реактив готують безпосередньо перед проведенням дослід-жень; 7) стандартний розчин сечовини – 0, 5 г еталону розчиняють в 1 л дистильованої води. Еквівалент концентрації – 8, 33 ммоль/л.
Хід визначення. Сечу фільтрують, потім готують розведення 1: 25 або 1: 50. У центрифужну пробірку вносять 0, 8 мл дистильованої води, 0, 2 мл розведеної сечі і 1 мл трихлороцтової кислоти, перемішують і через 10–20 хв центрифугують 15–20 хв при 3000 об/хв. У пробірку відбирають 0, 5 мл надосадової рідини і додають 5 мл кольорового реактиву. Пробір-ку закривають корком, обгорнутим фольгою, витримують у киплячій водяній бані точно 20 хв і охолоджують 2–3 хв струменем води з крану. Не пізніше, ніж через 15 хв вимірюють екстинцію проби на КФК при довжині хвилі 500–600 нм проти контролю у кюветі товщиною робочого шару 10 мм. Аналогічно обробляють 0, 5 мл стандарту сечовини і
контроль – 0, 5 мл дистильованої води.
Розрахунок вмісту сечовини проводять за формулою:
Сечовина (ммоль/л) 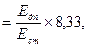
де Едп – екстинція дослідної проби; Ест – екстинція стандартного розчину; 8, 33 – концент-рація сечовини у стандартному розчині.
Результат множать на ступінь розведення.
Діагностичне значення визначення
сечовини
У сечі здорових високопродуктивних корів міститься 170–220 ммоль/л сечовини, у телят 20-денного віку – від 144 до 328, 30-денного віку – 78–260 ммоль/л. Уміст сечовини в сечі залежить від складу і кількості спожитого тваринами корму, є важливим діагностичним тестом функції печінки, де вона синтезується, і нирок, через які вона виводиться. Частіше зустрічається зменшення вмісту сечовини, що свідчить про ураження нирок. При гострій нирковій недостатності рівень сечовини в сироватці крові зростає до 50–80 ммоль/л і навіть більше, а виділення її з сечею різко зменшується. Якщо вміст сечовини сягає 35 ммоль/л, то це вказує на середній ступінь ураження нирок. При хронічному перебігу гломерулонефриту та в азотемічній стадії нефротичного синдрому вміст сечовини в сироватці крові підвищується до 13–15 ммоль/л, а в терміналь-ній стадії хронічної ниркової недостатності – до 30–35 ммоль/л. Кількість азоту сечовини у фракції залишкового азоту збільшується до 90 %. Об’єктивно оцінити здатність нирок до екскреції сечовини можна за допомогою визначення фактору концентрації сечовини (ФКС), який вираховується відношенням кількості виділеної нирками сечовини до її вмісту у сироватці крові:
ФКС = Сечовина сечі, ммоль/л: сечовина крові, ммоль/л.
У клінічно здорових високопродуктивних корів протягом перших трьох місяців після отелення ФКС знаходиться у межах 31, 0-90, 0, тоді як при нефротичному синдромі цей коефіцієнт знижується у 95-100 % тварин до 6–35, 7 (19, 4±3, 6) у глибокотільних і 7, 5–53 (25, 6±2, 6) – у дійних корів. При розвитку гепаторенального синдрому виведення сечовини нирками у глибокотільних корів зменшується на 25 %, а у дійних – на 27, 5 %, при цьому фактор концентрації сечовини вірогідно знижується у корів обох фізіологічних груп (23, 1±2, 4 у сухостійних, 26, 7±2, 1 - у дійних). Ці зміни є об’єктивним показником порушення екскреторної функції нирок. У телят, хворих на колібактеріоз, здатність нирок екскретувати сечовину на 3-й день хвороби зменшується до 6–13 ммоль/л, тоді як у міру видужання ФКС поступово зростає і досягає рівня здорових телят (Вовкотруб Н.В., 2005).
2.7.3. Визначення креатиніну
Креатинін є кінцевим продуктом розщеплення креатину, який відіграє важливу роль в енергетичному обміні м’язової тканини. почи-нається синтез креатиніну в нирках, а закінчується у печінці, звідки він надходить у м’язову тканину і мозок. Тут він фосфорилується і перетворюється в креатинфосфат – сполуку, яка багата на макроергічні зв’язки і є джерелом енергії, необхідної для скорочення м’язів.
2.7.3.1. Визначення креатиніну
за колірною реакцією Яффе
Принцип методу. Креатинін у лужному середовищі реагує з пікриновою кислотою з утворенням сполуки оранжево-червоного кольору, що має максимум поглинання при довжині хвилі 510 нм. Інтенсивність забарвлення пропорційна концентрації креатиніну.
Обладнання: фотоелектроколориметр, водяна баня.
Реактиви (склад набору): 1) реагент 1 (10 %-ний розчин NаОН) – 105 мл; 2) реагент 2 (насичений розчин пікринової кислоти) – 105 мл;
3) реагент 3 (креатинін, 440 мкмоль/л) – 5 мл.
Використовують набір реактивів НВФ “Simko-Ltd” (м. Львів).
Хід визначення. Сечу розводять дистильованою водою в 10 разів. Змішуванням одного об’єму реагенту 1 з одним об’ємом реагенту 2 готують робочий реактив (зберігає стабільність не менше 4 год при кімнат-ній температурі). До 0, 1 мл розведеної сечі додають 2 мл робочого реактиву. Перемішують, інкубують протягом 15 хв у водяній бані при температурі 37°С. Аналогічно обробляють 0, 1 мл реагенту № 3 (креатинін-еталон з концентрацією 440 мкмоль/л) та 0, 1 мл дистильованої води (контроль).
Проти контролю відразу визначають оптичну густину креатинін-еталону і досліджуваних проб при довжині хвилі 490–510 нм. Стабільність кінцевої реакції зберігається не більше 30 хв.
Розрахунок проводять за формулою:
Креатинін (мкмоль/л) 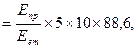
де Епр – екстинція досліджуваної проби (розведеної в 10 разів сечі); Еет – екстинція креатинін-еталону (реагент № 3); 5 – концентрація креатиніну в реагенті № 3, виражена мг/100 мл; 10 – фактор розведення сечі перед аналізом; 88, 6 – коефіцієнт перерахунку мг/100 мл в мкмоль/л.
Приклад: Поглинання досліджуваної проби – 0, 275
Поглинання креатинін-еталону – 0, 279
Вміст креатиніну в досліджуваній пробі буде:
0, 275: 0, 279 × 5 × 10 × 88, 6 = 4366, 5 мкмоль/л.
Кліренс креатиніну розраховують за формулою:
Кліренс (мл/хв) = 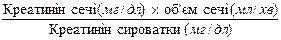 .
.
Приклад. Концентрація креатиніну в сечі = 0, 275: 0, 279× 5× 10 = 49, 3 мг/дл
Концентрація креатиніну сироватки = 124 мкмоль/л або 1, 4 мг/дл
Об’єм сечі (мл/хв) = 1900 мл: 1440 хв = 1, 32 мл/хв
Кліренс креатиніну = 49, 3 × 1, 32: 1, 4 = 46, 48 мл/хв
Примітка. Об’єми досліджуваних зразків та реагентів можна пропорційно зменшувати або збільшувати. Наприклад: до 0, 05 мл проби додати 1, 0 мл робочого реактиву або до 0, 15 проби додати 3 мл робочого реактиву. Далі див. хід визначення.
Реакція є лінійною в діапазоні 0–1320 мкмоль/л (0–15 мг/дл) креатиніну.
Речовини, що спотворюють результати: реакція Яффе не є специфічною. Речовини з активною метиленовою групою, глюкоза, стабілізатори, що присутні в більшості комерційних сироваток, деякі ліки та інші речовини завищують результати.
Стабільність досліджуваних зразків. Креатинін зберігається в сечі протягом тижня при 0–8 °С або до 3-х місяців у замороженому стані. Добову сечу стабілізують додаванням 15 г борної кислоти.
Діагностичне значення визначення
креатиніну
Визначення креатиніну широко використовують у клінічній практиці як показник кліренсу нирок, який вказує на кількість плазми або сироватки крові, що за одиницю часу повністю очищається від введеної речовини. Вміст креатиніну в сироватці крові збільшується, а в сечі знижується при порушенні фільтраційної функції нирок, оскільки креатинін, що фільтрується у первинну сечу, не реабсорбується у канальцях і повністю екскретується з сечею.
Концентрація креатиніну в сечі клінічно здорових високопродуктив-них глибокотільних корів становить 5, 5–14, 0 ммоль/л (в середньому 10, 8±1, 5), у дійних – 9, 2–13, 7 ммоль/л (11, 4±0, 6). Збільшення концентрації креатиніну в сироватці крові спостерігається при гострій нирковій недостатності, м’язових дистрофіях, коліках.
При нефротичному синдромі вміст креатиніну в сечі зменшується у 87, 5-95 % корів; у глибокотільних – до 7, 4±0, 9; дійних – до 4, 4±0, 5 ммоль/л. У корів з ознаками гепаторенального синдрому концентрація креатиніну в сечі становить 5, 0-6, 0 ммоль/л. Відношення між кількістю креатиніну в сечі і крові – концентраційний індекс (КІ) креатиніну – характеризує концентраційну функцію нирок:
КІ = Креатинін у сечі (мкмоль/л): креатинін у крові (мкмоль/л).
У людей концентраційний індекс перевищує 60. Величина його у сухостійних корів, хворих на жирову гепатодистрофію, зменшується до 27, 6±3, 0 (13, 6–45, 4) проти 66, 2±9, 9 (36, 0–90, 0) – у клінічно здорових. У дійних корів цей показник ще менший і становить 23, 4±2, 0 (6, 4–48, 7) проти 72, 7±5, 9 (51, 0–99, 7) – у клінічно здорових. Про порушення концентраційної функції нирок при нефротичному синдромі свідчить вірогідне зниження концентраційного індексу креатиніну (КІ) майже вдвічі у сухостійних корів і в 3 рази - у корів у період ранньої лактації порівняно з клінічно здоровими. У телят, хворих на колібактеріоз, клубочкова фільтрація в нирках у період розпалу зазнає значних змін, про що свідчить зниження КІ до 25, 8±5, 6 порівняно з 58, 4±14, 4 – у клінічно здорових (Вовкотруб Н.В., 2005).
2.7.4. Визначення індикану в сечі
Індикан утворюється в організмі внаслідок гнильних процесів у кишечнику і при розпаді білків тканин організму. З амінокислоти триптофану під впливом ферментів гнильних бактерій утворюється індол, який надходить у печінку й окиснюється в індоксил, а потім знешкоджується внаслідок утворення з активованою сірчаною кислотою парної сполуки – індоксилсірчаної кислоти. Утворена сполука виводиться із сечею у вигляді калійної солі, яка й називається індиканом.
У клінічній практиці індикан у сечі визначають якісними пробами Обермайєра і Яффе, які грунтуються на перетворенні індикану під дією кислоти в індоксил, що окиснюється з утворенням синього або червоного індиго. Кількість індикану в сечі визначають за кольоровою реакцією Розе.
2.7.4.1. Проба Яффе
Принцип методу. При дії на сечу концентрованою сірчаною кислотою індоксилсірчана кислота гідролізується в індоксил, який при додаванні хлороформу і розчину калію перманганату окиснюється в синє індиго. Інтенсивність забарвлення хлороформу синім індиго залежить від концентрації індикану в сечі.
Реактиви: 1) концентрована сірчана кислота; 2) хлороформ; 3) 2 %-ний розчин калію перманганату; 4) гіпосульфіт кристалічний.
Хід визначення. До 8–10 мл сечі додають рівний об’єм концентрованої сірчаної кислоти, 1–2 мл хлороформу і 1–2 краплі 2 %-ного розчину калію перманганату. Пробірку щільно закривають корком і перемішують, перевертаючи її. В присутності індикану хлороформ забарвлюється в блакитний, синій або рожевий колір. За наявності в сечі йодистих солей також утворюється рожеве забарвлення, яке зникає після додавання кристалика гіпосульфіту, що використовується для диференціювання індикану від йодидів. Інтенсивність забарвлення оцінюють у плюсах: різко позитивна реакція (++++) має фіолетове забарвлення; позитивна (+++) – різко-синє і синє (++); слабопозитивна (+) – блідо-синє.
2.7.4.2. Проба Обермайєра
Принцип методу. Аналогічний пробі Яффе.
Реактиви: 1) суміш із 0, 2–0, 4 г заліза хлориду і 100 мл концентрованої соляної кислоти (реактив нестійкий); 2) хлороформ.
Хід визначення. До 10 мл сечі додають рівну кількість реактиву 1 і через 5 хв – 1–2 мл хлороформу. Пробірку закривають корком і перемішують кілька разів. Синє забарвлення хлороформу вказує на наявність у сечі індикану.
Діагностичне значення індиканурії
Кінь за добу виділяє із сечею від 0, 78 до 2, 0 г індикану, собаки – від 10 до 43 мг (Синьов А.В.). Збільшення його кількості в сечі, за якої якіс-ні проби стають позитивними, називають індиканурією. Індиканурія при патології має кишкове або тканинне походження. Кишкова індиканурія виникає при атонії, непрохідності та запальних процесах у кишечнику, особливо при інтенсивному розвитку в ньому гнильної мікрофлори, що спричиняє гниття білків корму. Значне збільшення вмісту індикану в сечі є ознакою розвитку гнильних процесів у кишковому каналі або перитоніту. Тканинна індиканурія спостерігається при розпаді пухлин, травматичному перикардиті, гангрені легень, великих абсцесах та септичному стані. На відміну від кишкової індиканурії, при тканинній, окрім індикану, в сечі виявляють альбумози.
2.8. визначення макроелементів у сечі
2.8.1. Визначення хлоридів у сечі
за Фольгардом
принцип методу. Натрію хлорид сечі осаджується розчином срібла нітрату у вигляді нерозчинного срібла хлориду. Частку срібла нітрату, яка не вступила в реакцію з хлоридами сечі, визначають титруванням розчином амонію роданіду. Інтенсивне червоне забарвлення, яке утворюється при взаємодії сірчанокислого окису заліза з амонію роданідом, свідчить про закінчення реакції.
Обладнання: бюретки, пробірки, піпетки, колби.
Реактиви: 1) титрований 0, 1 н розчин срібла нітрату (16, 994 г на 1 л дистильованої води); 2) титрований 0, 1 н розчин амонію роданіду: 8 г амонію роданіду розчиняють у 900 мл дистильованої води, потім цим розчином титрують із бюретки суміш, яка складається із 20 мл титрованого розчину срібла нітрату і 5 мл розчину залізо-аміачних квасців, підкислену азотною кислотою до знебарвлення. Титрування проводиться до появи слабого червоного забарвлення всієї рідини. На осадження 20 мл титрованого розчину срібла нітрату необхідно використати 20 мл амонію роданіду. Якщо кінцева реакція настає раніше, то розчин амонію роданіду доливають дистильованою водою до необхідної концентрації і титрують знову; 3) насичений розчин квасців залізоаміачних; 4) розведена азотна кислота (щільність 1, 2).
Хід визначення. У мірну колбу на 100 мл наливають 10 мл досліджуваної сечі, яку попередньо підкислюють 2–5-ма краплями азотної кислоти, додають 2 мл розчину квасців залізоаміачних. Сеча коней набуває червоно-бурого забарвлення, для зменшення інтенсивності якого необхідно додавати 10–15 крапель розчину калію марганцевокислого. Якщо забарвлення не змінюється, то сечу підігрівають на водяній бані.
Для осадження всього хлору у вигляді нерозчинного срібла хлориду до безбарвної сечі додають 15–20 мл титрованого розчину срібла нітрату і доливають дистильованою водою до 100 мл. Уміст закритої колби струшують і після 5-хвилинного відстоювання фільтрують через сухий фільтр до прозорого фільтрату. 50 мл такого фільтрату титрують роданідом амонію до легкого червонуватого забарвлення.
|
|