
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Рівняння стану ідеального газу. Теплоємність ідеального газу.
|
|
Стан заданої маси визначається значеннями трьох макропараметрів: тиску р, об’єму V і температури Т. Зазначений зв'язок може бути заданий аналітично у вигляді функції 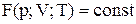 . Співвідношення, що визначає зв'язок між параметрами p, V і Т, називається рівнянням стану. Найпростішими властивостями володіє газ, взаємодією між молекулами в якому зневажають. Такий газ називають ідеальним. Рівняння стану ідеального газу має вигляд:
. Співвідношення, що визначає зв'язок між параметрами p, V і Т, називається рівнянням стану. Найпростішими властивостями володіє газ, взаємодією між молекулами в якому зневажають. Такий газ називають ідеальним. Рівняння стану ідеального газу має вигляд:
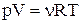 .
.
Це рівняння називають рівнянням Менделєєва–Клапейрона. n – кількість речовини, що вимірюється в молях. Моль – міра виміру речовини кількістю частинок. В одному молі будь–якої речовини вміщується стільки ж частинок, скільки їх знаходиться у вуглеці масою 0, 012 кг. Це число називають числом Авогадро:
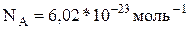 .
.
R – універсальна газова стала:
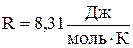 .
.
Маса одного моля речовини називається молярною масою:
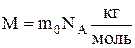 .
.
Теплоємністю тіла називають фізичну величину, яка дорівнює кількості теплоти, яка необхідна тілу для нагрівання на 1 К:
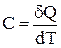 ,
,  .
.
Теплоємність одного моля речовини називається молярною теплоємністю:
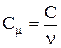 ,
, 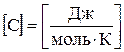 .
.
Теплоємність одиниці маси речовини називають питомою теплоємністю:
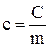 ,
, 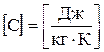 .
.
Між молярною і питомою теплоємністями існує зв'язок: 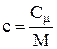 .
.
Теплоємність є функцією процесу, оскільки вона залежить від вигляду процесу, при якому систему переводять з одного стану в інший.
Ізопроцесом називають процес переходу газу з одного стану в інший при одному фіксованому макропараметрі. Процес, при якому об’єм газу залишається сталим, називається ізохоричним. З рівняння Менделєєва–Клапейрона випливає, що при незмінній кількості речовини 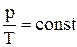 – закон Шарля: При постійному об’ємі відношення тиску до абсолютної температури є величиною сталою. Робота газу при ізохоричному процесі дорівнює нулю, оскільки dV = 0. Тоді математичне вираження першого закону термодинаміки приймає вигляд:
– закон Шарля: При постійному об’ємі відношення тиску до абсолютної температури є величиною сталою. Робота газу при ізохоричному процесі дорівнює нулю, оскільки dV = 0. Тоді математичне вираження першого закону термодинаміки приймає вигляд:
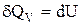 .
.
Для одного моля газу
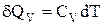 ,
,
де 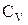 – молярна теплоємність газу при постійному об’ємі.
– молярна теплоємність газу при постійному об’ємі.
Після відповідної підстановки вираження для зміни внутрішньої енергії приймає вигляд:
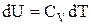
і
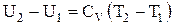 ,
,
відкіля одержуємо формулу внутрішньої енергії, як функцію температури:
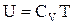 .
.
Для довільної маси газу остання формула приймає вигляд:
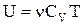 .
.
Процес переходу газу з одного стану в інший при постійному тиску називається ізобаричним. З рівняння стану ідеального газу випливає:
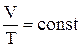 – закон Гей–Люссака: при постійному тиску відношення об’єму до абсолютної температури є величиною постійною.
– закон Гей–Люссака: при постійному тиску відношення об’єму до абсолютної температури є величиною постійною.
Математичне вираження першого закону термодинаміки для ізобаричного процесу має вигляд:
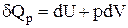 .
.
Розділивши ліву і праву частини останньої рівності на dТ одержимо:
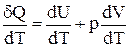
або
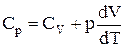 ,
,
де 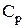 – молярна теплоємність газу при постійному тиску.
– молярна теплоємність газу при постійному тиску.
Рівняння стану одного моля ідеального газу має вигляд:
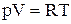 .
.
Продифференціював останнє рівняння з урахуванням сталості тиску, отримуємо:
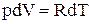
або
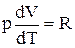 .
.
З останнього вираження випливає, що робота одного моля ідеального газу при ізобаричному нагріванні його на 1 К дорівнює універсальної газової сталої. Після відповідної підстановки формула молярної теплоємності при постійному тиску здобуває вигляд:
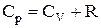 .
.
Отримане рівняння називається рівнянням Майєра.
Важливою характеристикою газів є відношення 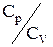 , що позначається буквою g і називається постійною адіабати. З урахуванням рівняння Майєра можна записати:
, що позначається буквою g і називається постійною адіабати. З урахуванням рівняння Майєра можна записати:
 ,
,
відкіля одержуємо формулу для молярної теплоємності при постійному об’ємі:
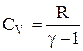 .
.
Підставивши отриману формулу у вираження для внутрішньої енергії, одержуємо:
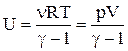 .
.
Ізотермічним називають процес переходу газу з одного стану в інше при сталій температурі. З рівняння Менделєєва–Клапейрона випливає закон Бойля-Маріотта: 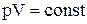 – при незмінній температурі добуток тиску на об’єм є величиною сталою. Оскільки Т = const, то внутрішня енергія системи не змінюється (dU = 0), і математичний вираз першого закону термодинаміки приймає вигляд:
– при незмінній температурі добуток тиску на об’єм є величиною сталою. Оскільки Т = const, то внутрішня енергія системи не змінюється (dU = 0), і математичний вираз першого закону термодинаміки приймає вигляд:
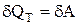
і
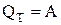 .
.
Визначимо роботу газу при ізотермічному розширенні:
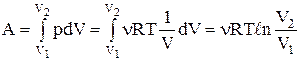 .
.
Таким чином, для збільшення об’єму газу від V1 до V2 при сталій температурі необхідно системі передати кількість теплоти:
Адіабатичним називається процес, що протікає без теплообміну з навколишнім середовищем. Оскільки 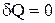 , то перший закон термодинаміки для адіабатичного процесу буде мати вигляд:
, то перший закон термодинаміки для адіабатичного процесу буде мати вигляд:
 .
.
Але 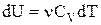 , а
, а 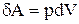 . Після підстановки одержуємо:
. Після підстановки одержуємо:
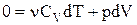 .
.
Оскільки 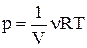 , то
, то 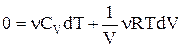 або
або 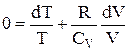 .
.
Останнє вираження являє собою диференціал суми логарифмів:
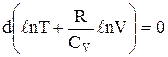 ,
,
відкіля випливає що 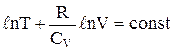 .
.
Враховуючи, що 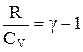 , то
, то 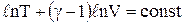 . Використовуючи властивості логарифмів (
. Використовуючи властивості логарифмів (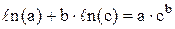 ), одержуємо:
), одержуємо:
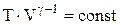 .
.
 Виразимо температуру з рівняння Менделєєва–Клапейрона і підставимо в останню формулу:
Виразимо температуру з рівняння Менделєєва–Клапейрона і підставимо в останню формулу:
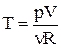 ,
, 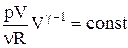 .
.
Але, оскільки 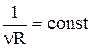 , то в остаточному підсумку одержуємо:
, то в остаточному підсумку одержуємо:
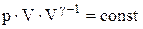
або
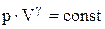 .
.
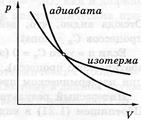
Отримане рівняння називається рівнянням Пуассона. Слід зазначити, що в природі в реальних умовах не існує ідеально ізольованих систем. Однак кількість теплоти, яким обмінюється система з навколишнім середовищем буде тим менше, чим менше часу триває процес. Тому близькими до адіабатичного є тільки процеси, які протікають дуже швидко. Графік адіабатичного процесу – адіабата. Зіставлення рівняння ізотерми 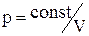 з рівнянням адіабати
з рівнянням адіабати 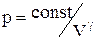 з урахуванням того, що g > 1, дозволяє зробити висновок, що адіабата йде крутіше, ніж ізотерма, тобто адіабатне розширення газу супроводжується його охолодженням.
з урахуванням того, що g > 1, дозволяє зробити висновок, що адіабата йде крутіше, ніж ізотерма, тобто адіабатне розширення газу супроводжується його охолодженням.
Політропічним називається процес переходу газу з одного стану в інше, при якому теплоємність залишається сталою (Сn = const). Рівняння залежності тиску від об’єму при політропічному процесі має вигляд:
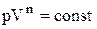 ,
,
де n – довільне число.
Оскільки 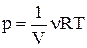 , то після підстановки одержуємо:
, то після підстановки одержуємо:
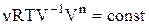 або
або 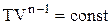 .
.
Отримане рівняння є рівнянням політропи в системі TV. Покажемо, що при політропічному процесі теплоємність газу залишається сталою. Математичний запис першого початку термодинаміки має вигляд:
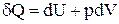 .
.
Розділимо ліву і праву частину на dТ:
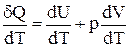 .
.
З огляду на те, що 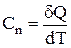 і
і 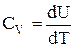 , одержуємо:
, одержуємо:
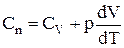 .
.
Оскільки 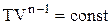 , то похідна від лівої частини дорівнює нулю:
, то похідна від лівої частини дорівнює нулю:
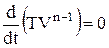 , і
, і 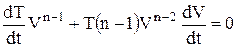 ,
,
відкіля випливає:
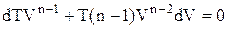
або
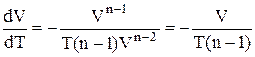 .
.
Для одного моля газу 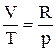 . Після підстановки одержуємо:
. Після підстановки одержуємо:
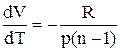 .
.
Підставимо останнє вираження у формулу теплоємності:
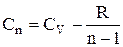 .
.
З огляду на те, що 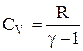 , остаточно одержуємо:
, остаточно одержуємо:
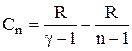 ,
,
відкіля випливає, що теплоємність речовини при політропічному процесі є величиною сталою.
Якщо 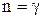 , то
, то 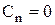 і
і 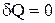 , тобто одержуємо адіабатичний процес. При
, тобто одержуємо адіабатичний процес. При 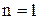 одержуємо
одержуємо 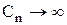 і Т = const, тобто ізотермічний процес.
і Т = const, тобто ізотермічний процес.
Визначимо роботу газу при політропічному процесі. З першого початку термодинаміки випливає:
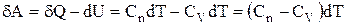 .
.
Для n молів газу
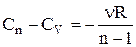 .
.
Тому вираження для роботи можна переписати у вигляді:
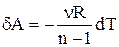 .
.
Повна робота дорівнює:
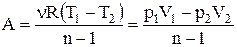 .
.
|
|