
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Тема 18
|
|
МЕТОД ФЛУОРЕСЦИРУЮЩИХ АНТИТЕЛ (МФА). ИММУНОФЕРМЕНТНЫЙ АНАЛИЗ (ИФА)
Цель занятия. Ознакомить студентов с принципом метода флуоресцирующих антител и техникой постановки реакции иммунофлуоресценции, с принципом и техникой проведения им-муноферментного анализа.
Оборудование и материалы. Инактивированные культуры бруцелл и сальмонелл, 96%-й этанол, ФСБР (рН 7, 2...7, 4), «влажная камера» (чашки Петри, эксикатор), люминесцирующие сыворотки против бруцелл, сальмонелл, иммуноглобулинов кролика, позитивная бруцеллезная сыворотка, готовый препарат для демонстрации результатов ИФА, люминесцентный микроскоп.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
В названных серологических реакциях используют антитела (иммунные сыворотки), меченные флуорохромом или ферментами, и в дальнейшем, применяя специальные методы, регистрируют образование комплекса антиген — антитело. В некоторых вариантах ИФА ферментную метку вводят в антиген.
Метод флуоресцирующих антител (МФА). Этот комплексный метод сочетает в себе серологическую реакцию, при которой происходит специфическое взаимодействие антигена и антитела с образованием иммунного комплекса, и микроскопическое исследование, с помощью которого этот комплекс обнаруживают.
В реакции иммунофлуоресценции используют антитела, к которым присоединен флуорохром (чаще флуоресцеин — изотиоцинат). Такие антитела сохраняют способность специфически реагировать с антигеном и благодаря флуорохрому светиться под воздействием ультрафиолетовых лучей. При постановке МФА микробный антиген фиксируют на предметном стекле и обрабатывают люминесцирующими антителами. Затем препарат отмывают водой от несвязавшихся антител и просматривают в люминесцентном микроскопе. Если антитела специфически соответствуют данному антигену, то они образуют с антигеном прочный комплекс и при люминесцентной микроскопии в препарате обнаруживают светящиеся микробные клетки (рис. 70).
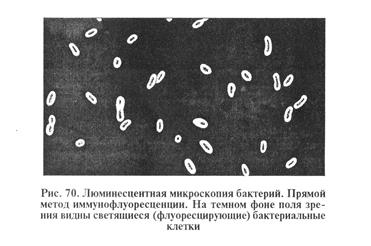
Преимущество МФА как диагностического метода состоит в том, что с его помощью возможно за два-три часа серологически идентифицировать микроорганизм непосредственно в патологическом материале, без выделения в чистой культуре (экспресс-метод). Как и другие серологические реакции, МФА применяют и для выявления антител в крови животных.
Приготовление препарата для МФА. При выявлении возбудителя инфекции (антигена) на предметном стекле готовят мазки-отпечатки из органов или другого материала. Чтобы обнаружить антитела в исследуемой сыворотке крови, на предметном стекле готовят мазки из известного антигена, например возбудителя сальмонеллеза, сибирской язвы и др. Препарат с нанесенным материалом (бактериальная суспензия, мазок-отпечаток) подсушивают на воздухе и фиксируют ацетоном (5 мин), или этанолом (10.... 15 мин), или метанолом (5...10 мин). Препарат можно фиксировать и нагреванием, как при обычной световой микроскопии. Мазки-отпечатки из органов и тканей лучше обрабатывать охлажденным до -20 °С ацетоном 2...4 мин. В зависимости от конкретных задач окрашивание готовых препаратов люминесцирующими сыворотками проводят различными способами.
Прямой МФА. Разработал Coons с соавт. (1950). На предметное стекло с фиксированным антигеном наносят каплю люминесцирующей иммунной сыворотки в рабочем разведении, содержащей антитела против искомого антигена. Чтобы избежать высыхания, препарат помещают во влажную камеру (чашку Петри) с фильтровальной бумагой, смоченной водой, и выдерживают в термостате при 37...38 °С 15...30 мин. Затем препарат 5... 10 мин промывают от несвязавшихся иммуноглобулинов проточной (водопроводной) водой с рН не ниже 7, 0. Промытый препарат высушивают фильтровальной бумагой и микроскопируют.
Прямой МФА используют только для идентификации неизвестного антигена; к его недостатку относят необходимость приготовления люминесцирующей сыворотки для каждого вида идентифицируемого микроорганизма.
Непрямой МФА. Применяют в двух вариантах.
Двухступенчатый МФА предложили Weller и Coons (1954). Этот вариант считают более универсальным, так как при помощи одной люминесцирующей антивидовой сыворотки можно выявлять различные виды микроорганизмов.
На антиген наносят каплю немеченной иммунной сыворотки (сыворотка первой ступени). Препарат выдерживают в термостате 15...30 мин, затем его промывают, чтобы удалить несвязавшиеся антитела иммунной сыворотки, и просушивают (см. прямой вариант). Если антитела сыворотки первой ступени соответствуют антигену, то вода не вымывает образовавшийся АГ—АТ-комплекс (антитела зафиксированы на антигене).
На подсушенный препарат наносят каплю люминесцирующей антивидовой сыворотки (сыворотка второй ступени) в рабочем титре. Препарат повторно помещают в термостат во влажной камере на 15...30 мин, затем промывают водой и подсушивают. Антивидовая сыворотка представляет собой меченные флуорохромом антитела против иммуноглобулинов крови животного того вида, от которого получена иммунная сыворотка первой ступени. Таким образом, антитела первой сыворотки служат антигеном для меченых антител антивидовой сыворотки. В результате к образовавшемуся на первом этапе АГ—АТ-комплексу присоединяются антитела второй ступени, образуется двойной комплекс, который можно обнаружить в люминесцентном микроскопе.
Универсальность непрямого варианта обусловлена тем, что, используя на первом этапе полученные от животных одного вида (например, от лошадей) иммунные сыворотки против различных микроорганизмов, на втором этапе с помощью одной антивидовой сыворотки можно идентифицировать неограниченное количество возбудителей инфекционных болезней.
Трехступенчатый МФА представляет собой вариант РСК на стекле. В данном случае в иммунном комплексе на стекле при помощи люминесцирующей сыворотки выявляют связанный комплемент (рис. 71).

Двухступенчатым или трехступенчатым МФА при использовании известного антигена можно обнаруживать антитела в крови животных.
Для подтверждения специфичности результатов МФА необходимы контроли. Для прямого варианта достаточно одного контроля: гомологичные и гетерологичные в антигенном отношении микроорганизмы обрабатывают люминесцирующей сывороткой. В первом случае наблюдают свечение бактерий, во втором свечение отсутствует.
Для непрямого варианта ставят два контроля: 1) мазки, содержащие гомологичные и гетерологичные в антигенном отношении микроорганизмы, обрабатывают антивидовой люминесцирующей сывороткой. При отсутствии антител первой ступени клетки не должны люминесцировать; 2) мазки с гомологичными и ге-терологичными в антигенном отношении бактериями обрабатывают иммунной (антимикробной) сывороткой (первый этап) с последующим нанесением флуоресцирующей антиглобулино-вой (антивидовой) сыворотки (второй этап). Специфическое свечение бактерий наблюдают в первом случае, во втором оно отсутствует.
Оценка результатов МФА. Учитывают яркость свечения, цвет, локализацию и структуру свечения. У бактерий, окрашенных (обработанных) люминесцирующей сывороткой, меченной изоцианатом флуоресцеина, обычно наблюдают яркое зеленое свечение по периферии клетки в виде ободка или ореола, центральная часть бактерий светится слабо. Такой характер свечения объясняют тем, что с единицы площади по периферии микробной клетки на сетчатку глаза наблюдателя проецируется в несколько раз больше антител, чем с центральной ее части. Следует учитывать, что у пластичных бактерий (лептоспиры, вибрионы) светится вся клетка. У клеток, погруженных в тканевую жидкость, и у молодых бацилл сибирской язвы контур обычно выражен нерезко.
Интенсивность свечения оценивают по четырехкрестовой системе: 1) (++++) — очень яркая флуоресценция по периферии микробной клетки, четко контрастирующая с темной центральной частью клетки; 2) (+++) — яркая флуоресценция периферии клетки; 3) (++) — слабое свечение периферии клетки; 4) (+) — нет контрастного свечения периферии и центральной части микробной клетки. Отсутствие специфического свечения обозначают знаком «минус» (видны тени микроорганизмов). При диагностике различных возбудителей болезней положительным результатом чаще считают специфическое свечение бактериальных клеток не ниже, чем на четыре или три креста.
Иммуноферментный анализ (ИФА). Этот метод получил распространение после того, как была решена задача введения ферментной метки в молекулы антител или антигенов. Антитела, связанные с ферментом, сохраняют способность специфически реагировать с гомологичным антигеном, а фермент — взаимодействовать с соответствующим субстратом.
ИФА обычно используют в гистохимическом (иммунопероксидазная реакция) и твердофазном вариантах.
Гистохимический ИФА. При помощи этого метода обычно обнаруживают микробные антигены в мазках-отпечатках, мазках крови, гистосрезах. Как и в случае МФА, пероксидазную реакцию используют в прямом и непрямом вариантах.
Прямая иммунопероксидазная реакция. В качестве известного компонента используют, меченные пероксидазой антитела против какого-либо патогенного микроорганизма. Препарат, например мазки-отпечатки, фиксируют охлажденным ацетоном (-15...-20 °С), подсушивают, наносят четыре-пять капель конъюгата в рабочем титре (меченые антитела), инкубируют во влажной камере при 37 °С 1...2ч, промывают физиологическим раствором 15 мин, ополаскивают дистиллированной водой, подсушивают, наносят на препарат несколько капель раствора субстрата (25 мг 3, 3-ДАБ • 4НС1 растворяют в 100 мл 0, 05 М трис-буфера с рН 7, 5 и 25 мл этого раствора объединяют с 3 мл 0, 5%-го раствора перекиси водорода). Препарат с субстратом выдерживают 5...10 мин, промывают в физиологическом растворе 10 мин, ополаскивают дистиллированной водой и микроскопируют.
Если в исследуемом материале присутствует искомый микробный антиген, то меченные пероксидазой антитела с ним специфически связываются. Внесение субстрата к пероксидазе приводит к образованию цветного продукта, видимого при микроскопии сначала как гранулы голубого, а позднее желто-коричневого цвета.
Непрямая иммунопероксидазная реакция. Как и в МФА, используют меченные пероксидазой антитела иммуноглобудинам определенного вида животных. На первом этапе фиксированный охлажденным ацетоном препарат с исследуемым материалом обрабатывают во влажной камере при 37...38 º С 1...2 ч. иммунной сывороткой (0, 2...0, 3 мл), содержащей немеченые антитела к искомому антигену. Затем препарат промывают физиологическим раствором 5 мин, подсушивают и обрабатывают при 37...38 °С 1...6ч во влажной камере антителами, меченными пероксидазой (конъюгат в рабочем разведении). Последующие операции и учет результатов аналогичны прямому варианту пероксидазной реакции.
Твердофазный ИФА. Применяют наиболее широко. В этом случае антитела или антигены фиксируют на нерастворимых носителях: микропанелях, стеклянных или нейлоновых шариках.
При различных вариантах реакции результаты учитывают инструментально или визуально.
Обнаружение антигена по схеме «сэндвич» состоит из следующих этапов.
Лунки полистироловых микропанелей, сенсибилизируют специфическими для искомого антигена антителами[2] в концентрации 10...30 мкг/мл. Обычно в лунку вносят по 0, 2 мл раствора антител в буфере с рН 9, 6, выдерживают при 37 °С 1 ч и затем оставляют на ночь при 4 " С. Удаляют раствор иммуноглобулинов панели промывают ФСБР (рН 7, 4) три раза, чтобы удалить избыток свободных (несорбированных) антител.
В лунки вносят по 0, 2 мл раствора, содержащего исследуемый антиген, и инкубируют при 37°С 2 ч, затем панели вновь промывают, как ранее описано.
В лунки вносят по 0, 2 мл меченных ферментом специфических антител (конъюгат); панели инкубируют при 37 °С 1...2ч, затем их отмывают от несвязавшихся антител.
В лунки вносят 0, 2 мл раствора ферментного субстрата [ортофенилендиамин (ОФД) или
5-аминосалициловая кислота — для пероксидазы и р-нитрофенилфосфат — для щелочной фосфатазы] и инкубируют в темноте при 20...22 º С 5...30 мин.
Реакцию останавливают добавлением 0, 05 мл 2 н. раствора серной кислоты (для пероксидазы) и 3 М раствора гидроксида натрия (для щелочной фосфатазы).
Учет результатов визуальный или спектрофотометрический по увеличению поглощения при длине волн 490 нм (пероксидаза) или 405 нм (щелочная фосфатаза). Субстрат ОФД: положительный результат — оранжево-коричневое окрашивание. Субстрат 5-аминосалициловая кислота: положительный результат — интенсивное коричневое окрашивание.
За положительный результат принимают превышение оптической плотности опытных образцов над контрольными в пять-шесть раз.
Обнаружение антител (в сыворотке крови) основано на том же принципе, но твердофазный носитель сенсибилизируют известным антигеном, обрабатывают исследуемой сывороткой, затем антивидовым иммуноглобулином, меченным ферментом. Вносят субстрат и по цветной реакции судят о наличии или отсутствии антител в исследуемой сыворотке крови.
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ
1. Идентифицировать культуры возбудителей бруцеллеза и сальмонеллеза прямым МФА.
2. Идентифицировать двухступенчатым МФА культуру сальмонелл.
3. Изучить микроскопическую картину при учете результатов гистохимического ИФА (иммунопероксидазный тест).
Контрольные вопросы
1. В чем сущность одноступенчатого, двухступенчатого и трехступенчатого МФА?
2.Для каких целей используют МФА?
3.Какие разработаны варианты ИФА?
|
|