
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Атом(ион) , принявший электронную пару на свою свободную валентную орбиталь, называется акцептором
|
|
Билет №11
Ковалентная связь - это химическая связь, образованная электройнной парой, общей для двух атомов.
Основных характеристик для ковалентной связи 5: длина связи, энергия связи, ее пространственная направленность, поляризация и поляризуемость.
Длина связи – расстояние между ядрами атомов, ее образовавшими.
Энергия связи – энергия, необходимая для гомолитического разрыва связи на радикалы или на атомы.
Направленность - одно из важнейших свойств. Она обуславливает пространственную структуру молекул т.е. их форму.
Полярность- характеристика химической связи, показывающая перераспределение электронной плотности в пространстве вблизи ядер по сравнению с исходным распределением этой плотности в нейтральных атомах, образующих данную связь.
Поляризуемостью ковалентной связи и (или) молекулы называют ее способность под действием внешнего электрического поля становиться полярной или более полярной. Поляризуемость π -связи выше, чем поляризуемость σ -связи. Поляризуемость молекулы возрастает с увеличением ее объема и числа π -связей.
Электронная пара, связывающая атомы и создающая ковалентную связь, возникает из неспаренных электронав атомов. В результате образования общей электронной пары атомы оказываются в состоянии непрерывного обмена электронами. Такой механизм называется – обменный механизм.
Донорно-акцепторный механизм – образование ковалентной связи за счёт двухэлектронного облака одного атома(донор) и свободной орбитали другого(акцептор).
Атом(ион), давший электронную пару для образования химической связи, называется днором
Атом(ион), принявший электронную пару на свою свободную валентную орбиталь, называется акцептором
Примерами образования химической связи по донорно-акцепторному механизму являются:
а) реакция аммиака с ионом водорода:
H+ + ׃ NH3 = NH4+
Роль акцептора электронной пары играет пустая орбиталь иона водорода. В ионе аммония NH4+ атом азота четырехвалентен.
б) такая связь образуется между атомом азота в молекуле метиламина CH3NH2 и протоном H+ кислоты HCl: 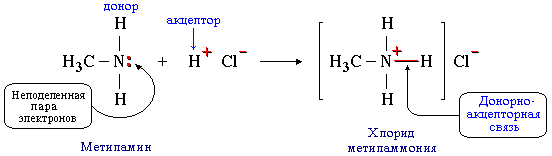
Атом азота отдает свою электронную пару на образование связи и выступает в роли донора, а протон предоставляет вакантную орбиталь, играя роль акцептора. Атом-донор при этом приобретает положительный заряд.
Основные положения метода ВС:
1)Химическая связь между комплексообразователем и лигандами образуется по донорно-акцепторному механизму
2)Орбитали комплексообразователя подвергаются гибризации, что и определяет геометрию комплексных ионов
3)Магнитные свойства комплексов обусловлены наличием неспаренных электронов, но магнитные свойства надо знать заранее
Когда собственная орбиталь не принимает участие –внешнеорбитальная гибридизация
Как правило такие комплексы неустойчивы (если они еще и парамагнетики, то их называют высокоспинновые)
2)по какому-то не понятному механизму электроны на 3d орбитали спариваются и происходит внутриорбитальная гибридизация (устойчивы)
Метод ВС описывает строение комплекса
Концепция гибридизации атомных орбиталей
Гибридизация орбиталей центрального атома - выравнивание их энергии и формы.. Сущность гибридизации атомных орбиталей состоит в том, что электрон вблизи ядра связанного атома характеризуется не отдельной атомной орбиталью, а комбинацией атомных орбиталей с одинаковым главным квантовым числом. Такая комбинация называется гибридизованной орбиталью.
В результате гибридизации появляются новые гибридные орбитали, которые ориентируются в пространстве таким образом, чтобы расположенные на них электронные пары (или неспаренные электроны) оказались максимально удаленными друг от друга, что соответствует минимуму энергии межэлектронного отталкивания. Поэтому тип гибридизации определяет геометрию молекулы или иона.
|
|