
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Второй закон термодинамики.
|
|
ТЕРМОДИНАМИКА РАВНОВЕСНЫХ СОСТОЯНИЙ
методические указания по подготовке коллоквиумов,
контрольные вопросы и задания
Екатеринбург
Материал подготовлен кафедрой физической химии
Составители:
А.Ю. Зуев,
Д.С.Цветков
Коллоквиум 1.
Первый закон термодинамики. Термохимия.
Вопросы к коллоквиуму.
1. Основные понятия химической термодинамики: Термодинамическая система (изолированная, замкнутая, открытая). Состояние системы. Процесс (обратимый, необратимый, циклический). Свойства системы (экстенсивные, интенсивные). Внутренняя энергия, теплота, работа. Свойства (функции) состояния и математическое описание изменения этих свойств. Первый закон термодинамики и его различные формулировки. Аналитическое выражение первого закона термодинамики для различных систем. Роль трудов Ю.Майера и Д.Джоуля в формулировании этого закона.
2. Приложение 1 закона т/д для анализа различных обратимых процессов (изотермический, изохорический, изобарический и адиабатический) с участием идеального газа. Аналитическое и графическое представление циклических процессов. Расчет работы и теплоты в различных процессах и циклах.
3. Калорические коэффициенты (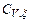 ,
, 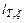 ,
, 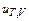 и СРx, hT, x, hT, P-) и связи между ними.
и СРx, hT, x, hT, P-) и связи между ними.
4. Термические коэффициенты (a, b, c, kДТ) и связи между ними.
5. Применение 1 закона т/д к системам, в которых протекают химические взаимодействия. Правило Гесса, как следствие 1 закона т/д. Соотношение между теплотами реакций при постоянном объеме и постоянном давлении.
6. Стандартные энтальпии образования веществ, стандартные теплоты химических реакций (сгорания, нейтрализации и др.). Примеры расчетов тепловых эффектов химических реакций по таблицам стандартных энтальпий образования и сгорания веществ.
7. Зависимость теплот реакций от температуры. Дифференциальная и интегральная формы уравнения Киргоффа.
Вопросы для самоконтроля.
1. Приведите примеры интенсивных и экстенсивных свойств; свойств (функций) состояния и свойств (функционалов) процесса.
2. Покажите математические следствия, применимые к анализу изменений свойств состояния термодинамической системы. На примере 1 моля идеального газа покажите, что объем (температура) является свойством состояния, а теплота – нет.
3. Запишите аналитическое выражение для закона сохранения энергии на примере изолированной и открытой систем.
4. На примере простейшей системы (n молей идеального газа в цилиндре с поршнем) показать, что работа и теплота не являются свойствами состояния.
5. На примере простейшей системы определите работу и теплоту в различных процессах (изотермическом, изохорическом, изобарическом и адиабатическом).
6. Выведите уравнение адиабаты для одного моля идеального газа. Докажите, что при изотермическом и адиабатическом переходе идеального газа кривые изотерма и адиабата пересекаются лишь в одной точке.
7. Имеем два цилиндра с поршнем, снабженные манометром и термометром. Известно, что в одном из них находится одноатомный, а в другом – двух атомный газ. Как экспериментально установить атомарность газов?
8. При температуре 300 K идеальный газ изотермически и обратимо расширяется от 10-2 до 10-1 м3. Теплота этого процесса составляет 17, 23 кДж. Поглощается или выделяется теплота газом? Сколько молей газа участвует в процессе?
9. Цикл Майера состоит из последовательности следующих переходов (процессов): изохорический нагрев, изотермическое расширение и изобарическое сжатие. Постройте этот цикл в координатах Р-V, Р-Т и V-T. Рассчитайте работу данного цикла.
10. Цикл Карно состоит из двух адиабатных и двух изотермических переходов. Постройте этот цикл в координатах Р-V, Р-Т и V-T. Рассчитайте работу данного цикла.
11. Цикл Стирлинга состоит из двух изотермических и двух изохорных переходов. Постройте этот цикл в координатах Р-V, Р-Т и V-T. Рассчитайте работу данного цикла.
12. Цикл Отто состоит из последовательности следующих переходов (процессов): адиабатическое сжатие, изохорический нагрев, адиабатическое расширение, изохорическое охлаждение. Постройте этот цикл в координатах Р-V, Р-Т и V-T. Рассчитайте работу данного цикла.
13. Цикл Джоуля состоит из последовательности следующих переходов (процессов): адиабатическое сжатие, изобарическое расширение, адиабатическое расширение, изобарическое сжатие. Постройте этот цикл в координатах Р-V, Р-Т и V-T. Рассчитайте работу данного цикла.
14. Цикл Дизеля состоит из последовательности следующих переходов (процессов): адиабатическое сжатие, изобарическое расширение, адиабатическое расширение, изохорическое охлаждение. Постройте этот цикл в координатах Р-V, Р-Т и V-T. Рассчитайте работу данного цикла.
15. Определите физический смысл калорических коэффициентов 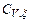 ,
, 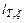 ,
, 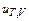 .
.
16. Определите физический смысл калорических коэффициентов СРx, hT, x, hT, P.
17. Докажите, что калорический коэффициент 
18. Докажите, что калорический коэффициент 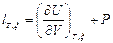
19. Докажите, что калорические коэффициенты СРx и 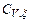 связаны соотношением
связаны соотношением 
20. Покажите связь между термическими коэффициентами, где 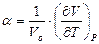 -коэффициент термического расширения тела;
-коэффициент термического расширения тела; 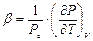 - изохорный коэффициент изменения давления;
- изохорный коэффициент изменения давления;  - коэффициент изотермического сжатия.
- коэффициент изотермического сжатия.
21. Для 1 моля этанола (r=0.79 г/см3 при 273 K и 1 атм) в интервале температур 273-323 К и давлений 1-1000 атм коэффициент термического расширения определяется соотношением 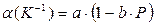 , а коэффициент сжатия равен
, а коэффициент сжатия равен 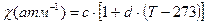 . Найдите уравнение состояния этанола, если известно, что a =1.11*10-3 K-1, b =1.3*10-4 атм-1, c =7.22*10-5 атм-1, и d =2*10-3 K-1.
. Найдите уравнение состояния этанола, если известно, что a =1.11*10-3 K-1, b =1.3*10-4 атм-1, c =7.22*10-5 атм-1, и d =2*10-3 K-1.
22. С помощью уравнения состояния жидкого этанола, полученного в предыдущей задаче, определите, насколько следует повысить температуру 1 моля этанола от начального значения (273 K) при неизменном объеме, V0=V273, чтобы его давление увеличилось от 1 до 100 атм.
23. С помощью уравнения состояния жидкого этанола, полученного в задаче 21, определите изменение объема 1 моля этанола при его нагреве от 273 до 323 K при давлении 1 атм.
24. С помощью уравнения состояния жидкого этанола, полученного в задаче 21, определите изменение объема 1 моля этанола при его сжатии от 1 до 1000 атм при 273 K.
25. Для фреона коэффициент Джоуля –Томпсона K ДТ=1, 2 К/атм. Какой перепад давления между компрессором и холодильной камерой (куда поступает фреон) нужно достичь, чтобы температура жидкости понизилась на 18 градусов?
26. Дайте строгое термодинамическое обоснование правила Гесса. Могут ли тепловые эффекты одной и той же реакции, проведенной при постоянном давлении и при постоянном объеме отличаться. При утвердительном (или отрицательном) ответах привести конкретные примеры.
27. Сжигание 1 моля угарного газа в кислороде проводят при 298 K в условиях V=Const и P=Const. Рассчитайте разницу между тепловыми эффектами QV и QP. Изменится ли эта разница (если да, то насколько) при повышении температуры до 400 К.
28. Сжигание 1 моля метана в кислороде проводят при 298 в условиях V=Const и P=Const. Рассчитайте разницу между тепловыми эффектами QV и QP. Изменится ли эта разница (если да то насколько) при повышении температуры до 400 К.
29. Для некоторой реакционной системы температурные зависимости суммарных 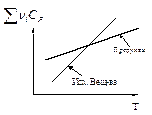 теплоемкостей исходных веществ и продуктов реакции показаны на рис.1. Представьте графически в координатах DH-T температурную зависимость теплового эффекта данной реакции.
теплоемкостей исходных веществ и продуктов реакции показаны на рис.1. Представьте графически в координатах DH-T температурную зависимость теплового эффекта данной реакции.
30. Для каких систем, в которых протекают химические реакции, повышение температуры приводит к увеличению теплового эффекта? Покажите в каких случаях тепловой эффект реакции не будет зависеть от температуры.
Коллоквиум 2.
Второй закон термодинамики.
Вопросы к коллоквиуму.
1. Вводные концепции и предпосылки принципа рассеивания энергии. Самопроизвольный и не самопроизвольный процесс. Формулировки второго начала термодинамики. Цикл Карно. Понятие энтропии по Р. Клаузиусу. Аналитическое выражение второго закона термодинамики. Приведенная теплота, некомпенсированная теплота. Изменение энтропии систем, в которых протекают необратимые процессы.
2. Объединенное выражение первого и второго начала термодинамики. Основные соотношения термодинамики в дифференциальном виде для 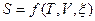 и
и  . Связи энтропии с термическими и калорическими коэффициентами.
. Связи энтропии с термическими и калорическими коэффициентами.
3. Изменения энтропии в простейших процессах (примеры для системы содержащей n молей идеального газа): изохорический, изобарический, изотермический, адиабатический. Энтропия изотермического смешения двух газов.
4. Изменение энтропии индивидуальных веществ при нагревании. Энтропия фазовых переходов. Тепловая теорема Нернста. Постулат М. Планка. Абсолютное значение энтропии. Стандартная энтропия вещества. Вычисление абсолютных значений стандартной энтропии для веществ в различных агрегатных состояниях на основе экспериментальных данных. Изменение энтропии в химических реакциях. Зависимость изменения энтропии в химических реакциях от температуры.
5. Статистический характер энтропии. Макроскопические и микроскопические состояния системы. Термодинамическая вероятность. Связь энтропии и термодинамической вероятности по Л. Больцману.
Вопросы для самоконтроля.
1. В чем ограниченность первого начала термодинамики?
2. Запишите аналитическое выражение второго начала термодинамики для обратимых и необратимых процессов.
3. Теплота является функцией процесса или, другими словами, функционалом. Покажите, что приведенная к температуре теплота dQ/T в обратимых процессах становится функцией состояния.
4. Понятие энтропии. Энтропия в открытых и изолированных системах. Принцип возрастания энтропии.
5. Запишите объединенное выражение первого и второго начал термодинамики в виде калорических дифференциальных уравнений.
6. Докажите справедливость соотношений: 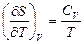 ,
, 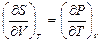 ,
, 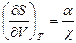 .
.
7. Докажите справедливость соотношений: 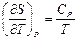 ,
, 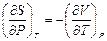 ,
, 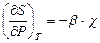 .
.
8. Докажите справедливость соотношений: 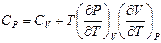 ,
,  .
.
9. Воспользуйтесь тем, что dS является полным дифференциалом, и найдите, чему равны частные производные 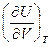 и
и  .
.
10. Раскройте статистический смысл энтропии. Определите понятия макро- и микропараметров, макро – и микросостояний, термодинамической вероятности. Формула для расчета энтропии по Л. Больцману.
11. Выведите выражения для расчета изменения энтропии простейшей системы (1 моль идеального газа) в частных процессах (изотермическом, изохорическом, изобарическом и адиабатическом).
12. Изменения энтропии в процессах фазовых переходов. Как изменится энтропия изолированной системы, в которой обратимо кристаллизуется жидкая фаза?
13. Укажите, в каких процессах, и при каких условиях изменение энтропии может быть равно работе процесса.
14. Возможен ли процесс, при котором теплота, взятая у нагревателя, полностью превращается в работу?
15. Постулат М. Планка. Абсолютные значения стандартных энтропий веществ. Изменение энтропии химических реакций в стандартных условиях. Зависимость энтропии реакции от температуры.
16. Изобразите в координатах P – V, Т – V и S – ln T термодинамический цикл, состоящий из следующих последовательных процессов: 1 ® 2 – изотермического, 2 ® 3 – изобарического и 3 ® 1 – адиабатического.
17. В цилиндре с поршнем находится 1 моль идеального газа. Система совершает циклический процесс, состоящий из последовательных переходов: 1 ® 2 изотермическое расширение, 2 ® 3 адиабатическое расширение, 3 ® 4 изотермическое сжатие и 4 ® 1 адиабатическое сжатие. Построить цикл в координатах P = P (V), S = S (ln T), и T=T(S). Доказать, что КПД цикла 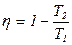
18. Цикл Отто состоит из последовательности следующих переходов (процессов): адиабатическое сжатие, изохорический нагрев, адиабатическое расширение, и изохорическое охлаждение. Построить цикл в координатах V = V (T), S = S (ln T) и T=T(S). Выразите КПД цикла через Т1, Т2, Т3, Т4 и степень сжатия e=V1/V2.
19. Вычислите изменение энтропии (при Т=298) при соединении двух баллонов, содержащих азот и кислород при следующих начальных условиях: VO2=10 л., PO2=10 атм, VN2=15 л., PN2=25 атм.
20. Два сосуда, разделенные краном и имеющие одинаковые объемы, V1=V2=1 л (при Р= 1 атм и Т=298 К), содержат водород и хлор соответственно. В темноте газы смешиваются, а затем под воздействием света протекает химическая реакция. Определите общее изменение энтропии системы. Для решения воспользуйтесь справочником.
21. Определите изменение энтропии при кристаллизации переохлажденной до –10 °С (Р=1атм). Для решения воспользуйтесь справочником.
22. Найдите выражение для внутренней энергии и энтропии газа, подчиняющегося уравнению Ван дер Вальса.
23. Моль идеального газа адиабатически расширяется от объема V1 до объема V2 в вакууме. Вычислить изменение энтропии для этого процесса.
24. Для газа, подчиняющегося уравнению Ван дер Вальса, выведите уравнение адиабаты (изоэнтропы).
25. Для газа, подчиняющегося уравнению Ван дер Вальса, вычислите разность теплоемкостей Cp-Cv.
26. Коэффициент термического расширения воды α при 4 °C меняет знак и в интервале температур 0< T °C< 4 является отрицательной величиной. Покажите, что в этом температурном интервале вода охлаждается при адиабатическом сжатии, а не нагревается, как другие жидкости и все газы.
27. Покажите, что теплоемкость Cv не зависит от объема у тех веществ, для которых давление линейно зависит от температуры.
Коллоквиум 3.
|
|