
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Аналитическое выражение первого закона термодинамики для неподвижного тела
|
|
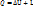
В данном термодинамическом процессе теплота расходуется в двух направлениях:
· На изменение внутренней энергии
· На совершение внешней работы
Энтальпия. Второй закон термодинамики
Энтальпия (i(h)) – термодинамическая функция, выражающая полную (внутреннюю и внешнюю) энергию системы и складывается из внутренней энергии ( ) и работы (pV), которую надо затратить, чтобы ввести тела объемом V в среду, имеющую давление р.
) и работы (pV), которую надо затратить, чтобы ввести тела объемом V в среду, имеющую давление р.
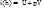
i(h) – удельная величина
[ i(h) ] = 1 Дж/кг
Второй закон термодинамики:
1) Самопроизвольное протекание естественных процессов возникает и развивается, если нет равновесия между термодинамической системой и окружающей средой.
2) Самопроизвольно протекающие в природе естественные процессы всегда протекают в одном направлении (от более высокого потенциала к более низкому).
3) Самопроизвольно протекающие естественные процессы направлены на достижение равновесия между термодинамической системой и окружающей средой и по достижении этого равновесия прекращаются.
4) Процесс может протекать в направлении, обратном самопроизвольному, если энергия для этого заимствуется из окружающей среды.
Энтропия. Физический смысл энтропии
Энтропия – параметр состояния рабочего тела, который устанавливает связь между количеством теплоты и температурой.
[S] = 1 Дж/кг 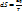
Энтропию можно определить, если известны два любых основных параметра состояния.
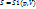


Физический смысл энтропии:
S – мера беспорядка
Возрастание беспорядка означает возрастание энтропии и рассеивание энергии. Например:
1) При подводе теплоты увеличивается хаотичность теплового движения частиц и увеличивается энтропия.
2) Охлаждение системы ведет к упорядочиванию и уменьшению энтропии.
3)При конденсации газа в жидкость молекулы занимают более определенные положения. Упорядоченность в системе растет, значение энтропии скачкообразно падает.
4)Когда жидкость превращается в твердое вещество, молекулы образуют правильные кристаллические решетки, т.е. упорядоченность растет, а энтропия уменьшается.
Энтропия. Третий закон термодинамики
Энтропия – параметр состояния рабочего тела, который устанавливает связь между количеством теплоты и температурой.
[S] = 1 Дж/кг 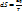
Энтропию можно определить, если известны два любых основных параметра состояния.
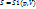


Физический смысл энтропии:
S – мера беспорядка
Возрастание беспорядка означает возрастание энтропии и рассеивание энергии. Например:
1) При подводе теплоты увеличивается хаотичность теплового движения частиц и увеличивается энтропия.
2) Охлаждение системы ведет к упорядочиванию и уменьшению энтропии.
3)При конденсации газа в жидкость молекулы занимают более определенные положения. Упорядоченность в системе растет, значение энтропии скачкообразно падает.
4)Когда жидкость превращается в твердое вещество, молекулы образуют правильные кристаллические решетки, т.е. упорядоченность растет, а энтропия уменьшается.
Третий закон термодинамики:
Такая закономерность позволяет предположить, что при нуле абсолютной температуры тепловое движение полностью прекратится, в системе установится максимальный порядок, т.е. энтропия станет равной нулю.
Такое предположение согласуется c опытом, но не поддается опытной проверке, т.к. абсолютный нуль не достижим, и называется третьим законом термодинамики.

Основные термодинамические процессы идеальных газов – изохорный, изобарный
1) Изохорный процесс (V=const)
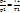 – закон Шарля
– закон Шарля
 В T-S координатах кривая изохорного процесса носит логарифмический характер.
В T-S координатах кривая изохорного процесса носит логарифмический характер. 
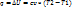
2) Изобарный процесс (p=const)
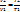 - закон Гей-Люссака
- закон Гей-Люссака
 В T-S координатах кривая также носит логарифмический характер, но изобара идет более полого чем изохора.
В T-S координатах кривая также носит логарифмический характер, но изобара идет более полого чем изохора. 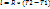
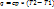
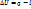
Основные термодинамические процессы идеальных газов – изотермический, адиабатный
1) Изотермический процесс (T=const)
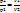 – закон Бойля-Мариотта
– закон Бойля-Мариотта
 В p-V координатах кривая процесса – равнобокая гипербола.
В p-V координатах кривая процесса – равнобокая гипербола. 
2) Адиабатный процесс(dQ=const, S=const)
– без теплообмена с окружающей средой
 В p-V координатах процесс описывается уравнением
В p-V координатах процесс описывается уравнением 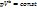 , где k – показатель адиабаты (
, где k – показатель адиабаты (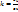 ).
). 
Процессы получения перегретого пара из влажного – изохорный, изобарный
Водяной пар – основное рабочее тело в паротурбинных установках электростанций, а также один из теплоносителей в теплообменных аппаратах ТЭС.
- реальный газ, в нем необходимо учитывать силы взаимодействия и объемы молекул, поэтому законы идеальных газов не распространяются на водяной пар.
Сухой насыщенный пар получается при испарении всей жидкости. Его состояние определяется всего 1 параметром (р или Т)
Влажный насыщенный пар получается при неполном испарении жидкости и является смесью сухого насыщенного пара и мельчайших капелек жидкости, равномерно распределенных на всем объеме и находящихся во взвешенном состоянии.
Степень сухости пара (х) – массовая доля сухого насыщенного пара во влажном.
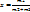 , где m2 – масса сухого насыщенного пара, m1 – масса воды.
, где m2 – масса сухого насыщенного пара, m1 – масса воды.
Состояние влажного насыщенного пара определяется двумя параметрами: р и х.
Перегретый пар получается при сообщении теплоты сухому насыщенному пару при p=const.
Перегретый пар по своим свойствам приближается к газам и тем ближе, чем выше степень его перегрева. Состояние перегретого пара определяется двумя параметрами: р и Т.
Расчет термодинамических процессов для водяного пара производится с помощью:
1)Термодинамических таблиц состояния воды и пара
2)Графического способа с помощью I-S диаграммы
 Кипящая вода
Кипящая вода  Влажный насыщенный пар (p=const, t=const)
Влажный насыщенный пар (p=const, t=const)  Сухой насыщенный пар
Сухой насыщенный пар  Перегретый пар (p=const)
Перегретый пар (p=const)
Критическая точка К имеет параметры, при которых кипящая вода сразу переходит в перегретый пар, минуя двухфазную область.
Основные термодинамические процессы получения перегретого пара из влажного в I-S диаграмме:

 1)Изохорный
1)Изохорный
Дано: p1, x1 (т.1) Определить: I1, I2, S1, S2 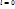
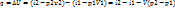
 2) изобарный
2) изобарный
Дано: p1, x1 (т.1)
Определить: i1, V1, t1, i2, V2
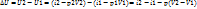
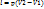
Процессы получения перегретого пара из влажного – изохорный, изобарный
Водяной пар – основное рабочее тело в паротурбинных установках электростанций, а также один из теплоносителей в теплообменных аппаратах ТЭС.
- реальный газ, в нем необходимо учитывать силы взаимодействия и объемы молекул, поэтому законы идеальных газов не распространяются на водяной пар.
Сухой насыщенный пар получается при испарении всей жидкости. Его состояние определяется всего 1 параметром (р или Т)
Влажный насыщенный пар получается при неполном испарении жидкости и является смесью сухого насыщенного пара и мельчайших капелек жидкости, равномерно распределенных на всем объеме и находящихся во взвешенном состоянии.
Степень сухости пара (х) – массовая доля сухого насыщенного пара во влажном.
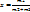 , где m2 – масса сухого насыщенного пара, m1 – масса воды.
, где m2 – масса сухого насыщенного пара, m1 – масса воды.
Состояние влажного насыщенного пара определяется двумя параметрами: р и х.
Перегретый пар получается при сообщении теплоты сухому насыщенному пару при p=const.
Перегретый пар по своим свойствам приближается к газам и тем ближе, чем выше степень его перегрева. Состояние перегретого пара определяется двумя параметрами: р и Т.
Расчет термодинамических процессов для водяного пара производится с помощью:
1)Термодинамических таблиц состояния воды и пара
2)Графического способа с помощью I-S диаграммы
 Кипящая вода
Кипящая вода  Влажный насыщенный пар (p=const, t=const)
Влажный насыщенный пар (p=const, t=const)  Сухой насыщенный пар
Сухой насыщенный пар  Перегретый пар (p=const)
Перегретый пар (p=const)
Критическая точка К имеет параметры, при которых кипящая вода сразу переходит в перегретый пар, минуя двухфазную область.
Основные термодинамические процессы получения перегретого пара из влажного в I-S диаграмме:
изотермический
Дано: p1, x1 (т.1), p2
Определить: i1, V1, S1, i2, V2, S2

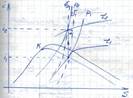
адиабатный
Дано: p1, x1 (т.1), p2
Определить: i1, V1, t1, i2, V2

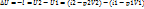
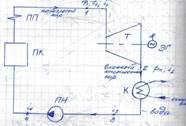
Цикл Ренкина. Термический КПД цикла
р1  12-14 МПа t1=545-565
12-14 МПа t1=545-565  tпв = 230-260
tпв = 230-260  рк
рк  3-5 кПа
3-5 кПа
ПК – паровой котел (парогенератор) ПП – пароперегреватель
Т – паровая турбина ЭГ – электрогенератор
К – конденсатор ПН – питательный насос
Пар из ПК поступает в ПП, откуда направляется в Т, где совершает работу, а Т в свою очередь вращает ЭГ. Пар после Т поступает в К, где от него отводится теплота охлаждающей (циркуляционной) водой. Образовавшийся конденсат ПН подается в паровой котел и цикл повторяется.
Подвод теплоты к воде в ПК для превращения ее в перегретый пар осуществляется за счет сжигания топлива.
 Теоретический цикл работы паротурбинной установки – цикл Ренкина – состоит из отдельный термодинамический процессов (с учетом работы, затрачиваемой на увеличение давления воды в ПН).
Теоретический цикл работы паротурбинной установки – цикл Ренкина – состоит из отдельный термодинамический процессов (с учетом работы, затрачиваемой на увеличение давления воды в ПН).
 1 – перегретый пар поступает в Т с р1 и t1
1 – перегретый пар поступает в Т с р1 и t1
1-2 – процесс адиабатного расширения от давления р1 до рк при S=const
2-3 – процесс конденсации пара в К при рк и tk=const
3-4 – процесс увеличения давления в ПН от рк до р1
Процесс 3-4 учитывается только в цикле Ренкина, поскольку i3 и i4 близки, модификация цикла сводит его в 1 точку.
4-5 – процесс нагревания воды в ПК до температуры насыщения (т.е. кипения)
5-6 – процесс парообразования в паровом котле (вода превращается в сухой насыщенный пар) при р1 и t=const
6-1 – процесс перегрева сухого насыщенного пара в ПП, происходящий при р=const
1)Количество теплоты, подведенной к 1 кг пара в цикле: 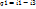
2)Количество теплоты, отведенной от 1 кг пара охлаждающей водой в К (потери теплоты): 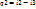
3)В полезную работу в Т превращается лишь часть теплоты: 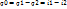
Термический КПД цикла – отношение теплоты пара, превращенной в полезную работу, ко всей теплоте, подведенной к воде и пару в цикле.
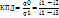
Цикл Ренкина имеет низкий КПД ( 36-37%), поэтому в «чистом» виде на электростанциях не используется. Для повышения КПД цикла используются модификации цикла Ренкина.
36-37%), поэтому в «чистом» виде на электростанциях не используется. Для повышения КПД цикла используются модификации цикла Ренкина.
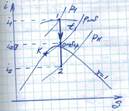
Цикл с промежуточным перегревом пара. Термический КПД цикла
Схема паротурбинной установки:
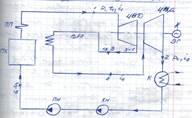
ЦВД – цилиндр высокого давления
ЦНД – цилиндр низкого давления
КН – конденсационный насос
ВПП – вторичный (промежуточный) пароперегреватель
Принцип работы:
Т состоит из двух цилиндров: ЦВД и ЦНД, а в ПК к основному ПП добавляется дополнительный теплообменник (ВПП). Перегретый пар (р1, t1) поступает в ЦВД Т, где, расширяясь, совершает работу. Приближаясь к состоянию сухого насыщенного пара (х  ), пар отводится из ЦВД во ВПП, в котором перегревается до более высокой температуры. ВПП расположен в ПК. Перегрев пара в нем осуществляется за счет теплоты продуктов сгорания топлива. Перегретый вторично пар возвращается в ЦНД Т и совершает в нем работу.
), пар отводится из ЦВД во ВПП, в котором перегревается до более высокой температуры. ВПП расположен в ПК. Перегрев пара в нем осуществляется за счет теплоты продуктов сгорания топлива. Перегретый вторично пар возвращается в ЦНД Т и совершает в нем работу.
1-3 – процесс адиабатного расширения пара от р1 до  в ЦВД
в ЦВД
3-4 – процесс изобарного перегрева пара во ВПП
4-2 – процесс адиабатного расширения пара от 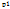 до рк в ЦНД
до рк в ЦНД
2-5 – процесс конденсации пар в конденсаторе при tk=const, pk=const
5-6 – нагрев воды до кипения в ПК
6-7 – процесс парообразования в ПК при p1=const, t1=const
7-1 – изобарный перегрев пара в основном пароперегревателе при р1=const
Термический КПД цикла:
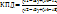 , где qЦВД=
, где qЦВД= 
qЦНД= 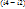 , qПК=
, qПК=  , qВПП=
, qВПП= 
Регенеративный цикл паротурбинной установки
Схема паротурбинной установки:
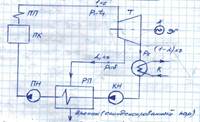
РП –регенеративный подогреватель
 - доля отбора
- доля отбора
Для повышения термического КПД цикла применяется регенеративный водогрев основного конденсата перед его поступлением в ПК. Не весь пар, поступивший в Т, расширяется до конечного давления рк (в К). Часть пара, совершив работу, отбирается из Т при некотором промежуточном давлении ротб (рк  ротб
ротб  р1) и направляется в РП. В этот же РП поступает основной конденсат после конденсатора Т. Пар из отбора нагревает основной конденсат, при этом превращается в дренаж (воду при tнасыщ, соответствующей давлению в отборе).
р1) и направляется в РП. В этот же РП поступает основной конденсат после конденсатора Т. Пар из отбора нагревает основной конденсат, при этом превращается в дренаж (воду при tнасыщ, соответствующей давлению в отборе).
Закон Фурье. Коэффициент теплопроводности
Теплообмен – обмен тепловой энергией между физическими телами или системами, вызванный разностью температур этих тел или систем. Такой перенос теплоты в соответствии с вторым законом термодинамики всегда направлен от более нагретых тел или систем к менее нагретым.
Теплопроводность – молекулярный перенос теплоты в сплошной среде. В этом случае теплота передается за счет непосредственного соприкосновения частиц, имеющих различную температуру, что приводит к обмену энергией между молекулами, атомами и свободными электронами.
В «чистом» виде явление теплопроводности наблюдается в твердых телах и неподвижных жидкостях или газах.
|
|