
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Некоторые свойства
|
|
При рассмотрении распределения Максвелла — Больцмана, бросается в глаза важное свойство — его можно представить как произведение двух множителей:
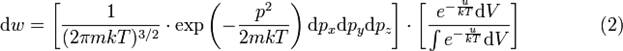
Первый множитель есть не что иное, как распределение Максвелла, оно характеризует распределение вероятностей по импульсам. Второй множитель зависит только лишь от координат частиц и определяется видом её потенциальной энергии. Он характеризует вероятность обнаружения частицы в объёме dV.
Согласно теории вероятностей, распределение Максвелла — Больцмана можно рассматривать как произведение вероятностей двух независимых событий — вероятность данного значения импульса и данного положения молекулы. Первая из них:
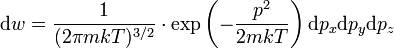
представляет распределение Максвелла; вторая вероятность:

— распределение Больцмана. Очевидно, что каждое из них нормировано на единицу.
Распределение Больцмана является частным случаем канонического распределения Гиббса для идеального газа во внешнем потенциальном поле, так как при отсутствии взаимодействия между частицами распределение Гиббса распадается на произведение распределений Больцмана для отдельных частиц.
Независимость вероятностей дает важный результат: вероятность данного значения импульса совершенно не зависит от положения молекулы и, наоборот, вероятность положения молекулы не зависит от её импульса. Это значит что распределение частиц по импульсам (скоростям) не зависит от поля, другими словами остается тем же самым от точки к точке пространства, в котором заключен газ. Меняется лишь вероятность обнаружения частицы или, что то же самое, число частиц.
Вопрос
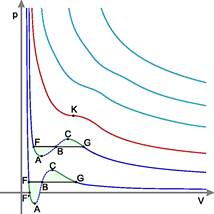 Изотермы реального газа (схематично)
Изотермы реального газа (схематично)
Синие — изотермы при температуре ниже критической. Зелёные участки на них — метастабильные состояния.
Участок левее точки F — нормальная жидкость.
Точка F — точка кипения.
Прямая FG — равновесие жидкой и газообразной фазы.
Участок FA — перегретая жидкость.
Участок F′ A — растянутая жидкость (p< 0).
Участок AC — аналитическое продолжение изотермы, физически невозможен.
Участок CG — переохлаждённый пар.
Точка G — точка росы.
Участок правее точки G — нормальный газ.
Площади фигуры FAB и GCB равны.
Красная — критическая изотерма.
K — критическая точка.
Голубые — сверхкритические изотермы
Реальный газ — газ, который не описывается уравнением состояния идеального газа Клапейрона — Менделеева.
Зависимости между его параметрами показывают, что молекулы в реальном газе взаимодействуют между собой и занимают определенный объём. Состояние реального газа часто на практике описывается обобщённым уравнением Менделеева — Клапейрона:
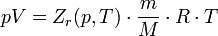
где p — давление; V - объем T — температура; Zr = Zr (p, T) — коэффициент сжимаемости газа; m - масса; М — молярная масса; R — газовая постоянная.
[править]
|
|