
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Химические связи
|
|
Основными элементарными частицами, из которых построены все известные нам вещества, являются протоны, нейтроны и электроны.
Из протонов и нейтронов состоят атомные ядра; электроны заполняют оболочки атома, компенсируя положительный заряд ядра.
Связи осуществляются в результате взаимодействия атомов (ионов) и валентных электронов, приводящего к понижению потенциальной энергии системы UПОТ и, прежде всего электронов, участвующих в связи. Тип связи зависит от электронного строения свободных атомов и, прежде всего, от строения их валентных оболочек. Состояние электронов в изолированном атоме и распределение электронов по оболочкам, подоболочкам и орбитам определяется 4 квантовыми числами.
Главное квантовое число n определяет размеры электронной оболочки в изолированном атоме, которую образуют электроны с одним главным квантовым числом. Энергия электрона обратнопропорциональна n2
Орбитальное квантовое число l оно определяет форму орбиты и величину момента количества движения электрона. Величина его меняется от 0 до n-1. электроны с одинаковым квантовым числом l входят в одну подоболочку. Обозначение подоболочек
l 0 1 2 3 4 …
обознач.подоболоч. s p d f g …
Магнитное квантовое число ml характеризует ориентацию плоскости орбиты электрона в пространстве. Его значение от –l до + l.
Спиновое квантовое число ms характеризует ориентацию собственного вращения электрона относительно оси Z. Принимает два значения +1/2 и –1/2.
Согласно принципу Паули, в атоме не может быть двух электронов с одинаковыми четырьмя квантовыми числами, т.е. на каждой орбите может находиться не более двух электронов с разными спинами. Данная конфигурация обладает наименьшей энергией при максимальном количестве не спаренных валентных электронов.
В атоме разрешенными для электронов орбитами являются только те, на длине которых (2π r) укладывается целое число длин (λ) волн Де-Бройля:
2π r=Kλ = K*h/mv (1)
Атомы, ионы, молекулы. Газы, жидкие и твердые тела могут состоять из атомов, молекул или ионов. Размеры атомов порядка ангстремов (1А=10-10 м), размеры положительных ионов - атомов, лишенных части электронов(меньше, чем атомов), и размеры отрицательных ионов присоединивших дополнительные электроны (больше, чем размеры соответствующих атомов), нескольких элементов показаны на рис. 2.
При сближении атомов до расстояния нескольких ангстрем между ними появляются силы взаимодействия. В зависимости от характера движения электронов с соседних атомах эти силы могу быть силами притяжения и отталкивания. В первом случае атомы могут соединятся с выделением энергии, образуя устойчивые химические соединения. Электроны внутренних полностью заполненных оболочек прочно связаны с ядром и не участвуют в образовании химических связей. Химические свойства атомов определяются строением внешней, не полностью заполненной оболочки. Электроны, находящиеся на внешней оболочки называются валентными.
Различают несколько видов химической связи.
Гомеополярная (ковалент ная) связь. При этой связи у веществ объединение атомов в молекулу достигается за счет электронов с противоположно направленными спинами, которые становятся общими для пар атомов. При возникновении ковалентной связи орбиты валентных электронов перекрываются. Чем больше перекрытие, тем прочнее связь.
Рис.2 Размеры атомов положи- Рис. 3 Гомеополярная связь в
тельных и отрицательных ионов молекуле хлора.
некоторых элементов в Å.
В молекуле Cl2 два атома, имеющие на внешнем слое по семи электронов, принимают устойчивую конфигурацию за счет объединениядвух общих электронов(рис. 3).В результате каждый атом повышает на единицу число электронов в своем валентном слое. Поскольку этот слой полностью заполняется, дальнейшее усложнение молекулы не может иметь места.
Молекулы с гомеополярной связью бывают неполярными или полярными (дипольными) в соответствии с симметричным или асимметричным строением. Молекулы, в которых центры положительных и отрицательных зарядов совпадают, называют неполярными. Если же в молекулах центры противоположных по знаку зарядов не совпадают и находятся на некотором расстоянии друг от друга, то такие молекулы называют полярными или дипольными. Примеры неполярной и полярной молекул показаны на рис. 4.
Рис.4 Примеры неполярной(сим-
метричной) и полярной(несим- Рис. 5 Структура алмаза,
метричной молекул. германия, кремния.
Дипольная(полярная) молекула характеризуется величиной дипольного момента, который определяется произведением заряда на расстояние между центрами положительных и отрицательных зарядов:
μ =q*l (2)
Заряда выражается величиной порядка 2*1019 Кл, расстояние составляет (1-3)*10-10 м. Поэтому дипольные моменты молекул обычно имеют величину порядка 5*10-29-10-30 единиц СИ.
В табл. 1 приведены значения дипольных моментов молекул некоторых веществ.
Таблица 1. Дипольные моменты молекул.
| Вещество | Химичес. формула | Дипольный момент в единицах СИ | Вещество | Химическая формула | Дипольный момент в единицах СИ |
 Сероуглерод
Четыреххлористый углерод
Бензол Сероуглерод
Четыреххлористый углерод
Бензол
| CS2 CCl4 C6H6 | Этиловый спирт Вода Мочевина | C2H5OH
H2O
H2N
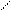 C=O
H2N C=O
H2N
| 0.57*10-29 0.62*10-29 1.5*10-29 |
Ковалентная связь типична для органических молекул. Вместе с тем она наблюдается и у твердых веществ неорганического происхождения, кристаллические решетки которых состоят из атомов. В этом случае ковалентная связь – результат взаимодействия валентных электронов и ионов остова вещества. Примером такого кристалла служит алмаз: его структура показана на рис. 5, из которого видно, каким образом каждый атом образует четыре связи со своими ближайшими соседями.
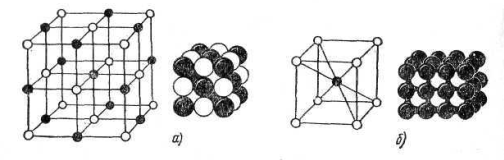
Рис. 6 Структура и плотная упаковка ионов хлористого натрия (а) и структура и неплотная упаковка ионов хлористого цезия (б)
Ковалентная связь характеризуется высокой прочностью. Подтверждением этому служит высокая прочность и высокая температура плавления таких веществ как алмаз, карбид кремния.
Гетерополярная (ионная связь) определяется силами электростатического притяжения (кулоновскими силами) между положительными и отрицательными ионами. При этом ионы достраивают свою внешнюю электронную оболочку до устойчивой конфигурации присоединением недостающих электронов(анионы) или отдачей электронов (катионы). Способность атомов захватывать электроны при образовании химической связи характеризуется его элетроотрицательностью. Наименьшей электроотрицательностью обладают щелочные металлы, которые легко отдают электроны. Наибольшую электроотрицательность имеют галогены, которые охотно принимают электроны для завершения внешней электронной оболочки.
Типичными примерами ионных кристаллов являются галоидные соли щелочных металлов. Вещества с ионной связью бывают с плотной и неплотной упаковкой. На рис. 6 показана структура хлористого натрия и хлористого цезия. Молекулы веществ с ионной связью полярны.
Металлическая связь существует в системах, построенных из положительных атомных остовов, находящихся в среде свободных, коллективизированных электронов (рис. 8, а). Притяжение между положительными атомными остовами и электронами обусловливает целостность металла. Металлическая связь до некоторой степени близка к ковалентной. Спецификой металлической связи является то, что в обобществлении электронов участвуют все атомы кристалла и обобществленные электроны не локализуются вблизи своих атомов, а свободно перемещаются внутри всей решетки, образуя «электронный газ». Не имея локализованных связей, металлические кристаллы (в отличии от ионных) не разрушаются при изменении положения атомов, т.е. им свойственна пластичность (ковкость) при деформациях. Благодаря наличию свободных электронов металлы обладают высокими электропроводностью и теплопроводностью.
Рис. 8 Схема строения металлического проводника(а) и образования межмолекулярной связи Ван-дер-Ваальса (б).
Молекулярная связь, или связь Ван-дер-Ваальса, наблюдается у ряда веществ между молекулами с ковалентным характером внутримолекулярного взаимодействия. Наличие межмолекулярного притяжения в этом случае возможно при согласованном движении валентных электронов в соседних молекулах (рис. 8, б). В любой момент времени электроны должны быть максимально удалены друг от друга и максимально приближены к положительным зарядам (ядрам). Тогда силы притяжения валентных электронов ядром соседней молекулы оказываются сильнее сил взаимного сталкивания электронов оболочек этих молекул. Связь Ван-дер-Ваальса является наиболее универсальной, она возникает между любыми частицами, но это наиболее слабая связь, энергия ее на два порядка ниже ковалентрной и ионной. Поэтому вещества с молекулярным характером связи обладают низкими температурами плавления (например, у парафина tпл ==50—52°С).
|
|