
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Микросом ал ьное окисление веществ
|
|
В микросомах находятся ферментные цепи окисления веществ. Они представлены двумя короткими цепями переноса электронов и протонов, вмонтированными в мембраны эндоплазматической сети или микросом. Когда говорят о микросомальном окислении, имеют в виду эти цепи. Одна из них — моноокси-
" геназная цепь окисления, в которой источником электронов и протонов является восстановленный НАДФ, а другая — редуктазная цепь окисления, в которой источником электронов и протонов служит восстановленный НАД. Последовательность переноса электронов в НАДФ • Н- и НАД'Н-зависимых цепях окисления показана на рис. 84. Источни ком НАДФ-Н для монооксигеназном цепи является пентозофосфатный цикл, а источником НАД • Н — гликолиз.
НАДФ • Н-зависимая моноок- сигеназная цепь микросом состоит из флавопротеида (ФП2), коферментом которого служит ФАД, и цитохрома Р450- Флавопротеид обладает НАДФ• Н-дегидрогеназной активностью, причем ФАД акцептирует 2Н+ и 2е~. С фл а во протеидов электроны транспортируются на цитохром Р450, а протоны в окружающую среду. Цитохром Р450 — последнее самоокисляющееся звено этой цепи. Как и все цитохромы, он относится к гемпротеидам. Белковая часть его представлена одной полипептидной цепью. Молекулярная масса цитохрома Р450 около 50 ООО. Он способен образовывать комплексы с оксидом углерода СО. Такой комплекс имеет максимум поглощения при 450 нм. Отсюда и название данного цитохрома. Цитохром Р450 выполняет двойную функцию: он активирует кислород посредством переноса на него электронов и использует активированный кислород для окисления вещества (R) и образования воды. В результате один атом кислорода включается в окисляемое вещество (RO), а другой, связывая два иона Н+ из среды, входит в состав воды.
НАД • Н-зависимая редуктазная цепь окисления содержится не только в мембранах микросом, она имеется также в наружной мембране митохондрий, ядерной мембране, клеточной мембране эритроцитов. Редуктазная цепь относится к самым быстрым реакциям биологического окисления, но функция ее в клетке окончательно неясна. Неизвестен также самоокисляющийся компонент этой цепи, который может активировать кислород (вполне возможно, что нм является то же цитохром Р450). НАД • Н- и НАДФ • Н-зависимые цепи окисления могут обмениваться электронами, например электроны с ФП2 и цитохрома В5 могут передаваться на цитохром Р4Б0 и использоваться в окислении субстратов (см. рис. 84).
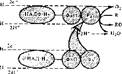 Рис 84 Схема монооксигеназной (верхняя) ц
Рис 84 Схема монооксигеназной (верхняя) ц
|
| ний'в микросомах (S• Н2 — субстрат, донор водорода; R — окисляемое соединение) |
Иногда ошибочно считают, что монооксигеназная цепь микросом предназначена для окисления ксенобиотиков. На самом деле она служит универсальной биологической системой окисления неполярных соединений любого происхождения, поскольку цитохром Р4Б0, непосредственно участвующий в окислении, находится в липидном слое мембран. Субстрат, окисляемый цитохромом Р480, должен отвечать одному требованию — быть неполярным, т. е. проявляется специфичность не к структуре субстрата, а к его физико-химическим свойствам.
Наиболее распространенные окислительно-восстановительные реакции
15-271
осуществляемые НАДФ «Ни НАД «Н-эависимыми цепями окисления мембран микросом (эндоплазматического ретикулума) печени, описаны ниже (классификация А. И. Арчакова).
НАДФ • Н-зависниые реакции. I. Окисление ксенобиотиков.
I. Окислительное N-, S- и О-деалкилированне. Например, окислительное N-деалкилирование диметнланилйна протекает по схеме
/Сн3 tX^^
j" ' ^CHj + НАДФ-Нг + 03 ^ + CHl° + НАДФ+ + Нз°
2. Гидроксилирование карбоциклических и гетероциклических соединений, например
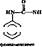
| (J) + НАДФ-Н2 + й О* + НАДФ" *> H2S |
| ' + надф+ + н, 0 + nhj |
| 6. Окислительное деза минирование. Например, амфетамин (психотропный препарат) дезаминируется по.схеме — ©г*- |
+ НАДФ+ + НгО
3. Гидроксилирование алифатических соединений. Например: СН, —|СНг)4—СН, + НАДФ • Hj -f- О, —СН^(СНг)^СН»ОН + НАДФ+ + НгО
4. N-Окисление. с образованием N-оксидов и N-гндроксиламинов. Например:
+ НАДФ Н, + О, [ОТ" + НАЛф4 + Н> °
5. S-Окйсление н десульфирование. Например, фенилтиомочевина подвергается S-окислению по схеме
II. Окисление природных субстратов:
1. «-Окисление ненасыщенных жирных кислот.
2. Гидроксилнрование различных стероидов, простагландинов.
III. Реакции восстановления ксенобиотиков (возможно, и некоторых природных субстратов). Особенностью этих реакций является то, что восстановление соединений происходит не на уровне цитохрома Рдо, а на уровне флавопротеида. С флавопротенда водород поступает ва субстрат. Имеется три типа этих реакций.
1. Восстановление азосоедивеннй:
№=n—^^ + знадф-н; ■»- 2 k»i+ 2надф+
азабскэол аншпш -
2. Bqcct ано& ление нктросоединений:
+ 2 Н70 +ЗНАДФ+
«dum
3. Восстановительное дегалогенирование: 2СН, С1+ НАДФ • Н, -1- 2CHaCi + НС1 + НАДФ+
НАД • Н-зависммые реакции:
I. Образование ненасыщенных жирных кислот из насыщенных.
II. Восстановление семндегидроаскорбнновой кислоты.
Ш. Реакции гндрокснлировання:
1. Гндроксвлированне кинурёнина.
2. Гидроксилнрование фенолов и анилина.
Масштабы деятельности моноокснгеиаз ио й цепн окисления веществ в печени очень велики. Уже сейчас известно свыше 7000 наименований соединений, окисляющихся этой цепью. Подобная универсальность мои ооксв ге на з - нон иен и дает возможность выполнять главную задачу — сделать вещество более полярным. В результате вещества легче растворяются в водной среде, подвергаются другим превращениям и выводятся яз организма. В большинст- ие случаев гндроксвлированне ксенобиотиков приводит к снижению нх токсичности. Но не всегда: например, моноорсигеназная цепь, окисляя нетоксичный бензпирен (содержащийся в табачром дыму, копченостях), приводит к образованию токсичного гидроксибенэпиреяа, являющегося канцерогеном. Образование токсических н биологических агрессивных продуктов в мовоок- сигеназной цепи окисления — это своеобразная «плата» за ее универсальность.
Прсцищш1я ксенобиотиков вне иикросом
| дгщ |
Превращения ксенобиотиков могут происходить также вве микросом клеток печени и других органов. Например, в митохондриях происходит окислительное дезамнннрованне алифатических и арилзамещенных аминов в соответ
ствующие альдегиды. В растворимой части цитоплазмы происходит окисление алифатических спиртов (метанола, этанола, бутанола и др.) алкогольдегид- рогеназой в соответствующие альдегиды, которые альдегиддегидрогеназой окисляются в органические кислоты. В пероксисомах возможен другой путь окисления этанола с участием каталазы по схеме.о
CHsCHsOH + HjO, -*CH3C: +2Н, 0 чн
К числу окислительно-восстановительных превращений ксенобиотиков относятся реакции ароматизации кольца или восстановления в нем двойных связей.
Большую группу превращений выполняют гидролазы, главным образом гидролдзы лизосом. К ним относятся:
1) эстеразы эфир©в..карбоновых кислот (псевдохолинэстераза, атропин- эстераза, коКаинэстераза, танинэстераза и др.);
2) эстеразы эфиров фосфорной кислоты (фосфомоноэстеразы, фосфоди- эстеразы, фосфоамидазы и др.);
3) эстеразы эфиров серной кислоты- (различные сульфатазы);
4) эстеразы глюкуронидов (fi-глкжуронндаэа).
Образующиеся под действием ферментов эндоплазм этической сети и других органоидов метаболиты ксенобиотиков являются реакционно-способными промежуточными соединениями. Они могут оказать побочное влияние на ткани организма, например мутагенное, канцерогенное, нммунодепрессивное, аллергическое и т. д.
Конъюгация ксенобиотиков, ее механизм и значение
КонъюгацМонная, или синтетическая, фаза необходима для образования не токсичных и легко выводимых продуктов метаболизма лекарств. По механизму реакции конъюгации делятся на два типа.
1 тип реакций. Сначала активируются конъюгирующие вещества, т. е. биомолекулы, а затем они переносятся на ксенобиотики с образованием конъюгата. Этот тип реакций конъюгации наблюдается во всех тканях организма.
И тип реакций. Сначала активируется ксенобиотик, который затем переносится на конъюгирующую биомолекулу с образованием конъюгата. Это редкий тип конъюгации. Он наблюдается только в печени и почках.
Имеются различные группы реакций конъюгации 1 и 11 типа в зависимости от природы участвующего в них конъюгирующего вещества. В I типе реакций конъюгации выделяются глюкуронидная, сульфатная, ацетильная, метильная, тиосульфатная, а во II типе-глициновая и глутаминовая.
Глюкуронидная конъюгация. Источником остатков глюкуроновой кислоты в этом процессе является УДФ-глюкуроновая кислота. Глюкуронидной конъюгации подвергаются природные соединения (известны глюкурониды билирубина, стероидных гормонов, витамина D и др.) и ксенобиотики. Последаие могут вступать в глюкуронидную конъюгацию, если они имеют или приобрели в ходе модификации гидроксильную, карбоксильную, аминогруппу (обычно у ароматического кольца) и в крайнем случае SH-группу. Реакция конъюгации протекает с участием УДФ-глюкуронозилтрансферозы по схеме
RXH + УДФ-С^О, -*• RX—С, H906 4- УДФ
Среди ксенобиотиков (лекарств и ядоа) глюкуронидной конъюгации подвергаются фенолы, полифенолы, фенольные стероиды, ароматические амины и т. д.
Сульфатная конъюгация. При осуществлении этой разновидности конъюгации предварительно образуется активная форма конъюгирующего вещества — 3'-фосфоаденоэин-5'-фосфосульфат (сокращенно ФАФС):
ФАФС, который можно записать как ФАФ—S03H, является источником подвижных сульфатных групп, используемые для конъюгации природных соединений и ксенобиотиков. Природными веществами, подвергающимися сульфатной конъюгации, являются эндогенные токси- но ческие продукты гниения белков в кишечнике: индол, скатол, фенолы, а также стероиды, иодтиронины, токоферолы, нафтохиноны и др. Чтобы подвергнуться сульфатной КОНЪЮ- У-фосф«тд«но1ин-У-фо«*осулкф»т гации, ксенобиотики (кстати так же, < фафс> как и природные вещества) должны
представлять собой, как правило, циклические структуры (карбоциклические или гетероциклические), содержащие свободные ОН- и ЫН2-группы.
Реакция сульфатной конъюгации происходит с участием специального фермента сульфотрансферазы по схеме RXH + ФАФ—вОэН -»• RX—SOsH + ФАФ
Следует отметить, что большинство веществ, структура которых подходит для сульфатной конъюгации, могут с равной долей вероятности подвергаться гюкуронидной конъюгации. Очевидно, все зависит от условий в месте локализации ферментов, осуществляющих ту или иную конъюгацию, и относительной специфичности этих ферментов к субстрату.
| I |
| н, о, ро |
Ацетильная конъюгация. Источником подвижных ацетильных групп в этой разновидности реакций конъюгации служит ацетил-КоА, который образуется в ходе распада углеводов, триацилглицеринов и аминокислот. Ацети- лированию могут подвергаться природные вещества и ксенобиотики, имеющие свободную NH2-rpynny. N-Аиетилирование служит необходимой биохимической реакцией для синтеза производных моносахаридов (N-ацетилглюкозами- на, N-ацетилгалактозамина, нейраминовой кислоты), использующихся в дальнейшем синтезе гетерополисахаридов. N-Ацетилирование является также одним из путей обезвреживания биогенных аминов — серотонина, гйстамина и др. N-Ацетклирование гистонов и негистоновых белков хроматина является важным механизмом регуляции транскрипции ДНК. Для природных веществ
известен единственный случай О- ацетилирования — это реакция образования ацетнлхолина.
Ксенобиотики, содержащие свободную NH2-rpynny (как правило, у ароматического кольца), подвергаются ацетил и рованию. Оно осуществляется при участии специальной ацетидтрансферазы, называемой арилаяин-Ы-ацетил- трансферазой (возможно, этих ферментов несколько). Этот фермент малоспецифичен по отношению к ацетилируемому ксенобиотику. Реакция протекает по схеме
о но
II! V
R—ЫНг + CHS— C~SKoA -»- R—N—С—СН3 4- KoASH-
Средн ксенобиотиков, подвергающихся ацетилированню, можно назвать сульфанвламиды, гидразиды нзоникоти новой кислоты, производные анилина, препараты которых широко используют в лечебной практике.
Метельная конъюгация. Конъюгирующим веществом в этой реакции являются «етяльные группы, источником которых- служит активная форма метионина S-аденозиляетионин. S-Адеиозилметионин участвует в многочисленных реакциях метилирование природных соединений. Он же служит донором метальных групп для реакций конъюгации ксенобиотиков (RXH), которые протекают с участием метилтрансфераз по схеме
RXH + S-АденозвлметконнЕ—RX—CHj-+-S - Аденоз ил гомоцистенн
Метвлированию подвергаются ксенобиотики, содержащие NH2-rpynny или азот в гетероцикле, ОН- и SH-группы, т. е. происходит нх N-, О- и S-метнли- рованне. Среди препаратов, используемых в медицине, подвергаются метилированию моно- и полифенолы, гетероциклические соединения типа пиридина, хнеолина, изохинолина, тноурацвла и др.
Тносудьф ат нам коиъюгация. Эта разновидность конъюгации используется при ферментативном обезвреживании цианидов. Конъюгирующим веществом в реакции является сера тиосульфата (редко другие серусодержащие соединения). Перенос серы от тиосульфата к иону цианида катализируется специфическим ферментом тиосулЬфат-сульфидтрансферазой - (прежнее название — роданеза; по схеме
CN- + S, Of- — SCN- + SO§-
Образующийся тиоцнаыат значительно менее токсичен, чем цианиды. Источником тиосульфата в тканях человека являются серусодержащие аминокислоты. Тиосульфатная конъюгация возможна с цианидами неорганического (синильная кислота, цианиды натрия иди квлия) и органического (ацетонитрнл, акрнлоннтрнл, бензилцнанид, нитрил миндальной кислоты, маловонитрнл, различные циан гидр инглюкозиды и галогенциавиды и -др.) происхождения, если последние освобождают в ходе гидролиза в организме цианид-нон.
Глициновая конъюгация. Относится к конъюгациям II типа, требующих предварительного активирования субстрата, но не коныогирующего вещества. Субстратом конъюгации в принципе могут служить любые карбоновые кислоты. Но алифатические, как правило, образуются редко, поэтому основным субстратом являются циклические карбоиовые кислоты.
Механизм глициновой конъюгации можно рассмотреть иа примере образования гиппуровой кислоты. Согласно механизму реакций конъюгации II типа при образовании гиппуровой кислоты сначала активируется бензойная кислота с участием арилацил-КоА-синтетазы по схеме
о
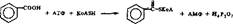 бекювнм кислота
бекювнм кислота
|
Затем происходит перенос бензоила (в других подобных реакциях конъюгации— любого чтиаировааного субстрата) на аминогруппу глицина, Этот процесс катализируется ацил-N-глицинтрансфераэой, которая специфична для ацялнровання глицина, а ее других аминокислот:

|
Аналогично проходит образование глициновых конъюгатов других соединений: ароматических кислот (никотиновой), феналзанещенных уксусных кислот (фенилухсусной, гидратроновой), р-замещенной пропионовой кислоты (0-О- толнлпропноновой), замещенных акриловых кислот (коричной, фурилакркло- вой, р-мегнлкоричной, фелландреновой), стероидных кислот (хояевой, дезок- снхолевоЙ).
Глутаминовая конъюгация — редкая разновидность конъюгации, которая наблюдается в ощутимых количествах у больных фенилкетонурией. У них образуются существенные количества фенилуксусиой кислоты, которая в печени н почках активируется с образованием феннлацетил-КоА к затем переносится на NHrгруппу глутамина. При этом образуется конъюгат-фенилацетил- глутамим, выделяющийся с мочой. Глутаминовая конъюгация ксенобиотиков в норме у человека ие наблюдается.
6. Условия, определяющие метаболизм лекарств
Метаболизм лекарств завнсат от многих факторов. К их числу относятся: генетические, возрастные, органоспеоифкческие, нейроэндокринные, способ введения и факторы внешней среды.
Модекудярно-генетлческие механизмы, определяющие метаболизм лекарств. Скорость метаболизма лекарств зависит от количеств»- ферментов, обеспечивающих модификацию и конъюгацию поступающего в организм препарата. При ферментопатиях, связанных с дефектом ферментов, участвующих в превращении лекарств, наблюдается снижение скорости метаболизма лекарственного. средства. Поскольку в большинстве своем метаболизм лекарств ведет к снижению их активности и токсичности, то при энзнмопатиях может неожиданно проявиться ненормально повышенная чувствительность тканей организма к введенному лекарству (если оно вводится в активной форме) и высокая его токсичность (побочное действие). Ферментопатии метаболизма лекарств являются частой причиной отрицательного действия многих лекарств. Приведем несколько примеров таких ферментопатий.
В плазме крови содержится холинэстераза, гидролизующая ацетилхолин, н неспецифичная псевдохолинэстераза, гидролизующая помимо ацетилхолина другие карбоксиэфиры. Оба фермента образуются в печени. При ферментопатии псевдохолинэстеразы наблюдается низкая активность ее в плазме крови. Применение у таких людей препарата днтилина в качестве миорелаксанта (расслабляющего скелетные мышцы), который гидролизуется псевдохолин- эстеразой, вызывает ненормально длительное действие его на организм — до нескольких часов (при норме в несколько минут).
Описаны у человека ферментопатии, связанные с реакциями конъюгации. Известны молекулярные болезни, вызванные дефектом УДФ-глюкуронозил- траисферазы. Они проявляются в виде двух форм наследственных гипербнли- рубинемий или желтух: гипербилирубинемия негемолитнческая наследственная с ядерной желтухой (синдром Криглера—Наджара) и гипербилирубинемия юношеская идиопатическая семейная (синдром Жильбера—Мейленграх- та). При этих молекулярных болезнях нарушена глюкуронидная конъюгация не только билирубина, но и других природных субстратов и лекарств. Поэтому назначение сульфаниламидов, салицилатов, препаратов, производных фенола, которые метаболнзируются посредством глюкуронидной конъюгации, резко усиливают признаки заболевания и проявляют отрицательное действие даже в обычных дозах.
Встречаются ферментопатии, связанные с ацетилнрованнем ксенобиотиков. У таких людей' низкая активность ариламин-М-ацетилтрансферазы, поэтому они медленно инактивируют (путем конъюгации) сульфаниламиды и противотуберкулезные препараты (п-аминосалициловую кислоту, изониазнд), чем и обусловлено их побочное действие на ткани организма. В связи с этим лечение изонназидом больных туберкулезом должно проводиться с учетом того, к какому типу пациенты относятся: к быстрым или медленным ннакти- ваторам.
Возрастные факторы метаболизма лехарств. Возраст существенно влияет на метаболизм лекарств. У новорожденных и детей примерно до восьминедельного возраста слабо развит ферментативный аппарат метаболизма ксенобиотиков. У них низкая активность монооксигеназной цепи окисления лекарств (в том числе и содержание цитохрома Р450) и других ферментов, в частности УДФ-глюкуронозилтрансферазы, по сравнению* со взрослым организмом. Поэтому у новорожденных встречаются физиологические желтухи, о чем говорилось ранее. Возрастную недостаточность этих ферментов не следует путать с энзимопатиями. По мере развития организма физиологическая недостаточность фермента исчезает; энзимопатии же остаются и у взрослого человека. Возрастная недостаточность обезвреживания лекарств у детей приводит к тому, что у них быстрее и от меньшей дозы проявляются побочные эффекты лекарств.
Органоспецифические факторы метаболизма лекарств. Основным органом метаболизма лекарств является печень. Поэтому при патологии печени возни-.
кают нарушения обезвреживания лекарств, что тоже ведет к повышению их токсичностиг и необычно высокой активности.
Нейроэидокринные факторы, определяющие метаболизм лекарств. Состояние нейроэндокринной системы влияет на активность ферментов метаболизма лекарств. Состояние напряжения, стресса ведет к повышению выделения кор- тикотропнна и соответственно глюкокортикоидов, которые увеличивают активность ферментов метаболизма лекарств. С разным действием на активность ферментов метаболизма лекарств женских и мужских половых гормонов связаны половые различия инактивации лекарств. Андрогены являются индукторами ферментов монооксигеназной цепи окисления и конъюгации лекарств, поэтому у мужчин лекарства обезвреживаются быстрее. Женщины, напротив, медленнее ннактнвируют лекарственные средства Возможно, это связано с тем, что эстрогены и прогестерон угнетают гидроксилирование ксенобиотиков в микросомах печени и активность УДФ-глюкуронозилтран сфер азы.
Зависимость метаболизма лекарств от способа введения. Способ введения лекарств определяет пути их превращений. При энтеральном способе введения лекарства подвергаются гидролитическому расщеплению ферментами желудочно-кишечного тракта, при всасывании с кровью воротной вены сразу поступают в печень. Поэтому энтеральный способ введения обусловливает интенсивные метаболические превращения лекарственных средств и более быструю их инактивацию. Из этого вытекает, что энтеральный способ введения более безопасен в отношении проявления токсических свойств препарата, но, с другой стороны, требует применения больших доз его для развития специфического эффекта. Особенности метаболизма лекарств при их энтеральном введении позволяют разрабатывать препараты кишечного действия. Для этих целей блокируются активные химические группы препарата, которые освобождаются прн гидролизе его ферментами кишечника.
При парентеральном способе введения лекарство вообще не проходит этап полостного метаболизма и не сразу поступает в печень. Поэтому скорость метаболизма его значительно ниже, а вероятность проявления побочного действия выше. Однако требуется гораздо меньшее количество препарата для достижения его максимального эффекта.
Влияние факторов внешней среды на метаболизм лекарств. Многие факторы внешней среды влияют на активность ферментных систем тканей организма, которые участвуют-®- метаболизме лекарств и тем самым изменяют их эффективность и токсичность. Замечено действие таких внешних факторов, как световой режим, температура среды, радиация и др. Действие этих факторов на ферменты реализуется не прямо, но косвенно — через нейро-эидокрин- ную систему. В то же время влияние эндокринных факторов на различные ферменты, обезвреживающие лекарства, неоднозначно: на одни ферменты они могут оказывать индуцирующее действие, на другие—или не влиять, или угнетать их активность. Поэтому алияние внешних факторов на метаболизм разных групп лекарственных средств (н, следовательно, на их активность и токсичность) зависит от того, как они воздействуют на активность ферментов, метаболизирующих конкретную химическую группу лекарственных веществ.
Увеличение продолжительности светового дня снижает активность ферментных систем микросомального окисления в печени; напротив, в ночное время активность их увеличивается. Поэтому скорость метаболизма препаратов ферментами эндоплазматического ретикулума печени ночью увеличивается, а днем уменьшается. Воздействие на организм ионизирующего облучения снижает обезвреживающую способность монооксигенаэной цепи окисления лекарств в печени.
Режим питания также существенно изменяет метаболизм лекарств. Голодание приводит к угнетению активности ферментов михросомальног© окисления большинства лекарств и повышает вероятность лекарственной интоксикации. Недостаток в пище белков оказывает примерно такое же влияние на метаболизм лекарств, что и голодание. При гиповитаминоза* Bi( Bj снижается гидроксилирование ксенобиотиков в микросом ах печени. Эти данные используют врачи для обоснования схем и режима назначения различных лекарств.
Особо следует остановиться на механизме регуляции различными лекарственными препаратами и прочими соединениями, с которым сталкивается человек, ферментативных процессов метаболизма ксенобиотиков. Среди них имеются вещества — индухторы н ингибиторы синтеза этих ферментных систем. В настоящее время известно свыше 200 препаратов, оказывающих индуцирующее действие на ферменты метаболизма лекарств, прежде всего микросомальных. К ним относятся бутадион (противовоспалительное), амидопирин (болеутоляющее), новокаин (местнообезболивающее), этвловый алкоголь и др. Наиболее мощным индуктором служит фенобарбитал (снотворное средство). Он резко увеличивает синтез ферментов микросомального окисления в печенн, воздействуя на генетический аппарат клеток печенн. Увеличение количества цепей микросомального окисления приводит к повышению метаболизма природных соединений н ксенобиотиков, окисляющихся ферментами этой цепи. Кроме того, фенобарбитал индуцирует синтез УДФ-глюкуронозилтрансферазы н облегчает протекание фазы конъюгации в метаболизме различных веществ. Остальные препараты обладают сходным, но более слабым действием.
Явление лекарственной (в частности, фенобарбиталовой) индукции объясняет привыкание к снотворным препаратам, относящимся к барбитуратам, и к другим лекарственным средствам, обезвреживающимся посредством окисления в монооксигенаэной цепи эндоплазматического ретикулума печени и глюкуронндной конъюгации. Таким образом, фенобарбитал как бы «готовит» почву для обезвреживания самого себя и других веществ, поэтому его полезно использовать для этих целей в практике, например при отравлениях или ДЛЯ усиления метаболизма эндогенных веществ (например, билирубина при физиологической желтухе новорожденных и врожденных гипербнлирубинемнях).
Назначение препаратов-индукторов совместно с другими лекарствами требует специального подхода. В противном случае можно не достичь желаемого лечебного эффекта от применяемой дозы препарата.
Индукторами ферментов лекарственного метаболизма являются биогенные препараты — тиамин, рибофлавин н их коферменты, карцитнн, пантоте- новая хнслота, ' андрогены, анаболические стероиды и др.; препараты эстрогенов и прогестерона угнетают эти ферменты.
Таким образом, с помощью препаратов биогенного происхождения н ксенобиотиков можно направить в нужное русло метаболизм эндогенных и поступающих в организм пациента соединений, в ходе которого изменяются их токсичность н активность.
I. Алифатические незамещенные амннокнсло' (моиоаминоконокарбоновые кислоты)
Глицин (гликокол), а-аминоук- сусная кислота
^ОН
|nh,
СННС—1cf
и. " он |н
I
III. Редкие аминокислоты белков
(спиртовое (пронноново-
брожение) кислое бро-
1. Распад глюкозы (гликолиз)
В клетках человека и других высших организмов (животных, растений) происходит молочно-кислое брожение, которое обычно называют гликолизом (от греч. «глнкис» — сладкий и «лизис» — распад, разложение). Следовательно, гликолиз — это анаэробный рас'йад Глюкозы до двух молекул молочной- кислоты.
Отдельные стадии гликолиза катализируются 11 ферментами. Они образуют цепь функционально связанных ферментов (солиферментная функциональная система), в которой продукт реакции предшествующего фермента является субстратом для последующего. Ферменты гликолиза локализованы вне митохондрий, в клеточном соке, где находятся в растворенном виде или лабильно соединены с мембранами эндоплазмдтической сети.
Распад глюкозы до молочной кислоты —-»кзергонический процесс. Освобождающаяся при этом энергия аккумулируется в фосфатных связях АТФ. Ферментативные реакции гликолиза в основном были изучены до 1940 г. В выяснении последовательности этих реакций большую роль сыграли работы немецких биохимиков Эмбдена и Мейергофа и советского биохимика Я. О. Парнаса, поэтому гликолиз называется иногда путем Эмбде'на—Мейергофа—Парнаса. 220
ГЛАВА 15. ВЗАИМООТНОШЕНИЕ И РЕГУЛЯЦИЯ РАЗЛИЧНЫХ ПУТЕЙ ОБРАЗОВАНИЯ ЭНЕРГИИ
1. Взаимоотношение аэробных и анаэробных путей образования энергии
Между обоими процессами — гликолизом и окислительным фосфорилирова- нием — существует тесная взаимосвязь несмотря на то, что они локализованы в разных участках клетки. На связь дыхания н гликолиза указывают два явления: эффекты Пастера и Кребтри. Эффект Пастера состоит в подавлении
[1] Энгельс ♦. Анти-Дюринг. М., Госполитиздат, 1977, с. 78.
[2] Структурная организация биологических мембран
Биологические мембраны отделяют клетку от внешней среды и разделяют е внутреннее пространство на «отсеки». Каждый из органоидов имеет мембрану, устройство которой определяется функцией субклеточной частицы. Однако принцнн строения для всех мембран примерно одинаков.
В 1931 г. Даниелли и Даусон предложили модель строения клеточной мембраны типа сандвича, которая впоследствии была несколько усовершенствована Робертсоном. Принцип построения такойчмембраны относительно несложен. Внутреннюю прослойку ее составляет бимолекулярный слой липидов, полярные головки которых обращены наружу. Белки мембран примыкают с обеих сторон к этим полярным головкам липидов. Такая модель объясняла, цочему через клеточную мембрану хорошо проходят соединения, растворимые в липи- дах, и не проникают гидрофильные вещества. Избирательная проницаемость для отдельных гидрофильных молекул объяснялась тем, что в бимолекулярном слое липидов имеются разрывы или поры, которые выстланы слоем белковых макромолекул Через них могут проходить разные водорастворимые соединения в зависимости от размеров пор, которые регулируются внешними факторами.
Долго считалось, что все мембраны построены по этому единому принципу
[3] Пути потребления кислорода в реакциях биологического окисления
Кислород, поступающий в клетки организма человека, ' расходуется не только на окисление субстратов в дыхательной цепи митохондрий, но и в других биологических реакциях. Все многообразие реакций, идущих с потреблением кислорода, можно свести к четырем основным типам.
[4] Распад углеводов в тканях
Известно несколько путей распада углеводов в тканях. Это гликолиз и его вариант гликогенолиз, которые являются вспомогательными путями образования энергии соответственно из глюкозы (или других моносахаридов) и гликогена при распаде их до лактата (в анаэробных условиях) Или до С02 и Н20 (в аэробных условиях). Гликолиз и гликогенолиз, несущие энергетическую функцию, подробно рассматривались ранее в разделе «Биоэнергетика».
Существует еще один путь распада углеводов в тканях, получивший название пентозофосфатного пути (гексозомонофосфатный или фосфоглюкОиат- ный шунт). По имени ученых, сыгравших основную роль в его описании,
[5] Биосинтез липидов в тканях
Синтез жирных кислот
В тканях организма происходит непрерывное возобновление жирных кислот, которые расходуются не только на энергетические нужды, но и на синтез многокомпонентных липндов (триацилглицеринов, фосфолипидов и т. д.). В клетках организма жирные кислоты заново синтезируются из простых фрагментов с участием полиферментного надмолекулярного комплекса, называемого синтетазой жирных кислот. В лаборатории Линена была выделена син- тетаза сначала из дрожжей, а затем из печени птиц и млекопитающих. Поскольку у млекопитающих синтезируется в основном пальмитиновая кислота, то этот полнферментный комплекс называют пальмитатсинтетазой.
Синтез жирных кислот имеет ряд особенностей:
]) в отличие от окисления синтез локализован в эндоплазматической
сети;
2) источником синтеза является малонил-КоА, образующийся из ацетил-
КоА;
3) ацетил-КоА непосредственно в реакциях синтеза используется только как затравка;
4) для восстановления промежуточных продуктов синтеза жирных кислот используется НАДФ ■ Н2;
5) все стадии синтеза жирной кислоты из малонил-КоА представляют
|
|