
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Глава 30. Функциональная биохимия почек
|
|
Почки выполняют следующие специфические функции: 1) мочеобразователь- ную и экскреторную; 2) регуляторно-гомеостатическую; 3) обезвреживающую; 4) внутрисекреторную.
Основной жизненно важной функцией почек является образование мочи и связанная с ней экскреция веществ, в том числе* чужеродных, попадающих в организм.
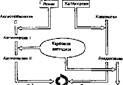
Функциональной единицей почек служит нефрон (рнс. 81). Образование мочи в нефропах достигается ультрафильтрацией плазмы крови в клубочках, реабсорбцйей веществ канальцами и собирательными трубками и секрецией в мочу и канальцев некоторых веществ. В сутки образуется до 180 л ультрафильтрата плазмы крови (первичная моча). Более99% ультрафильтрата реаб-
сорбируется. Объем конечной мочи составляет 1, 5—2, 0 л. Эпителий канальцев за сутки реабсорбирует огромную массу веществ: 179 л воды, 1 кг NaCl, 500 г NaHCO,, 250 г глюкозы, 100 г свободных аминокислот и т. д.
Все вещества первичной мочи делятся на пороговые и беспороговые. Первые реабсорбируются и потому имеют порог реабсорбции, вторые не реабсорбируются н выделяются в количествах, пропорциональных их концентрации в плазме крови. Реабсорбция происходит или простой диффузией, или активным транспортом. Большинство веществ рёабсорбнруется с помощью активного транспорта, требующего больших затрат энергии. Поэтому в канальцах почек чрезвычайно развита система активного транспорта веществ: высока активность Na+, К+- АТФазы, создающая Na+/^-градиент для вторичного активного транспорта, и систем белковых переносчиков для различных веществ.. Почки богаты митохондриями и отличаются высоким потреблением кислорода. Это дает возможность производить большое количество энергии в ходе окислительного фосфорилирования. В качестве источников энергии почки используют глюкозу, жирные кислоты, ацетоновые тела, аминокислоты.
1. Механизм образования мочи в различных отделах нефрона
Первичная моча образуется ультра фильтрацией крови черёэ поры базальной мембраны клубочка, размер которых около 4 нм. Ультрафильтрат содержит все компоненты плазмы крови, за исключением белков с молекулярной массой свыше 50 ООО.
 Рис. 81. Строение нефрона- - клубочек, 2 — проксимальной каналец; 3 я Генле; 4 — днсгальныв каналец, 5 — собнра.
Рис. 81. Строение нефрона- - клубочек, 2 — проксимальной каналец; 3 я Генле; 4 — днсгальныв каналец, 5 — собнра.
|
В проксимальных канальцах^ происходит реабсорбция веществ, которые делятся на три группы:, активно реабсорбирующнеся, слабо реабсорбирую- щиеся, нереабсорбирующиеся. Активно реабсорбируются: Na+, С1-, Н20, глюкоза и другие моносахариды, аминокислоты, Са, Mg2+, фосфаты неорганические, гидрокарбонаты, белки. Причем глюкоза и белки реабсорбируются почти полностью, аминокислоты — на 99%, Н20 — на 96, Na+ и С1~—на 70%, остальные вещества более чем наполовину. Ионы Na+ реабсорбируются эпителием канальцев посредством активного транспорта. Сначала они посту, -
пают в клетки эпителия, а оттуда в межклеточную среду. За Na+ из мочи пассивно следуют С1- и НСОГ по принципу электронейтральности, а вода — вследствие повышения осмотического давления в межклеточной среде. Из последней вещества поступают в кровеносный капилляр.
Глюкоза и аминокислоты транспортируются с помощью специальных переносчиков совместное Na+, используи энергию Ыа+-граднента на мембране. Са2+ и Mg2+ реабсорбируются, очевидно, с помощью транспортных АТФаз Белок реабсорбируется путем эндоцитоза. К слабо реабсорбирующимся ве ществам относятся мочевина и мочевая кислота. Они поступают простой диффузией в межклеточную жидкость, а из нее обратно в петлю Генле. К нереабсорбирующимся веществам относятся креатин, маннит, полисахарид инулчн ч др
Нисходящее и восходящее колено петли Генле образуют поворотно-про- тивоточную систему, которая участвует в концентрировании и разведении мочи {подробно этот процесс излагается в курсе физиологии), благодаря чему плотность мочи может колебаться от 1, 002 до 1, 030.
В дистальных канальцах происходят процессы реабсорбции Na+ и С1~ Здесь реабсорбируются оставшиеся 29% Na+ и С1— первичной мочи (всего в проксимальных и дистальных канальцах реабсорбируется до 99% Na+, и С! " "). Обратное всасывание Nа+ в дистальных канальцах имеет свои особенности. Во-первых, Na+ реабсорбируется независимо от воды. Происходит как бы «сухое» всасывание Na+ из мочи; за ним пассивно следуют ионы CI г Во-вторых, в обмен на поступающий в эпителий дистальных канальцев Na+ в мочу секретируются другие катионы — Н+, К+ и NH.(.+Источником Н+ являются Н2С03, которая образуется из С02 и Н20 при участии карбоангидразы и затем диссоциирует на Н+, НСОэГи органические субстраты, подвергающиеся дегидрированию с участием дегндрогеназ. Ионы NH4 образуются из Н+ и NH3. Последний образуется при дезаминировании глутамина под действием глутаминазы и а-аминокислот с участием оксид аз аминокислот. Ионы К+, имеющиеся внутри эпителия канальцев, так же как и ионы Н+, выделяются в мочу взамен на реабсорбируемый Na+ (причем К+ и Н4" могут взаимо- заменяться при секреции). При низкой концентрации К+ внутри эпителия канальцев секретируются ионы Н+ и наоборот.
Третьей особенностью реабсорбции Na+ а дистальных канальцах является его регулируемость альдостероном, который повышает скорость этого процесса.
В собирательных трубках протекает заключительная фаза реабсорбции. В них реабсорбируется вода и образуется окончательная моча. Проницаемость клеток собирательных канальцев для воды регулируется вазопресси- ном, который повышает реабсорбцию воды.
2. Регуляторно-гомеостатнческая функция
Мочеобразовательная функция почек тесно связана со способностью их регулировать осмотическое давление, водно-минеральный баланс и кислотно-щелочное равновесие внеклеточных жидкостей организма, в том числе крови.
Почки являются эфферентным звеном нейроэндокринной регуляции водно- солевого гомеостаза. При повышении осмотического давления крови вследствие избыточного потребления натрия или потери воды раздражаются осморе- цепторы. Возбуждение с них поступает в гипоталамус, что ведет к выделению вазопрессина. Последний усиливает реабсорбцию в собирательных трубках и уменьшает диурез. Задержка воды в организме снижает осмотическое давление. Одновременно развивается чувство жажды. Повышение концентрации натрия в крови подавляет секрецию альдостерона надпочечниками, который тормозит реабсорбцию натрия в дистальных канальцах и выведение его с мочой. В результате снижаются осмотическое давление крови и объем циркулирующей жидкости в кровеносной системе.
При избыточном потреблении воды увеличивается объем циркулирующей крови и раздражаются волюморецепторы сосудистой системы, реагирующие на объем циркулирующей жидкости. Импульсы от волюморецепторов поступают в гипоталамус, где тормозят секрецию вазопрессина, к способствуют выделению альдостерона надпочечниками. Это ведет, с одной стороны, к подавлению реабсорбции воды в собирательных трубках {снижение эффекта вазопрессина), а с другой — к повышенной реабсорбции натрия в проксимальных канальцах почек и потере с мочой калия {эффект альдостерона) Тем самым нормализуются объем циркулирующей крови и осмотическое дав- ■ ление.
Почки регулируют кислотно-щелочное равновесие крови, способствуя выделению кислых веществ с мочой и сохранению для организма щелочных резервов — гидрокарбонатов. В процессе обмена образуются преимущественно Кислые вещества {лактат, кетоновые тела, угольная кислота). Удаление летучих кислых веществ происходит через легкие, а нелетучих — через почки Анноны кислот нейтрализуются преимущественно катионами натрия, поэтому с мочой они выделяются в виде натриевых солей {NajHPO*, NaHCOj, NaCf, натриевых солей органических кислот и др.). Для сбережения гидрокарбоната, являющегося щелочным резервом крови, Na+ реабсорбируется в дистальных канальцах и заменяется в со^ях мочи на Н* н NH4, + продуцирующихся эпителием канальцев. За Na+ следует НСО^" и остается в организме. С мочой же выделяются более кислые соли {ЫаНгР04, 1ЧН4СГ) и кислоты {Н2СОз: молочная, ацетоуксусная, 0-гидроксимасляная). Реакция мочи становится вы- раженно кислой, рН может доходить до 4, 5 в то время как щелочные резервы крови сохраняются.
3. Обезвреживающая функция
В почках происходит обезвреживание чужеродных соединений путем образования парных соединений с глицином, уксусной и глюкуроновой кислотами, а также окисление некоторых органических спиртов и других веществ.
4. Внутрисекреторная функция
В клетках соединительной ткани почек образуются внеклеточные регуляторы типа гормоноидов, например простагландины. Кроме того, почки участвуют в гуморальной регуляции сосудистого тонуса и давления. Они выделяют в кровь протеолитический фермент — ренин, который отщепляет от белка плазмы полипептид ангиотензин 1. Неактивный ангиотензин I превращается в ангиотензин II карбоксикатепсином. Ангиотензин II стимулирует сокращение гладких мышц сосудов и секрецию альдостерона надпочечниками, что вызывает повышение кровяного давления.
Карбоксикатепсин, по В. Н. Ореховичу, является ключевым звеном ре- нин-ангиотензиновой и калликреин-кининовой системы. Первая повышает, а вторая снижает сосудистый тонус и давление. Карбоксикатепсин включает первую систему путем образования ангиотензина II и снимает эффект второй системы, расщепляя брадикинин (рис. 82).
5. Характеристика компонентов мочи в норме и патологии
Выделение с мочой различных веществ отражает изменение процессов в почках и других органах и тканях организма. Суточный объем конечной мочи, составляющий около 1, Ь—2 л, содержит примерно 60 г сухих веществ. Поскольку моча является фильтратом плазмы крови, то целесообразно рассмотреть присутствие в моче отдельных групп- биологических веществ, имеющихся в плазме.
В норме суточное выделение белков с мочой составляет всего около 30 мг, которое обычными лабораторными методами не улавливается и обозначается как «следы или отсутствие белков в моче». Среди белков, присутствующих в моче, имеются и ферменты. Происхождение нормальных белков мочи разное. Часть из них — это белки плазмы крови, которые до конца не реабсорбиро- вались, другая — белкн слущившихся клеток мочевыводящих путей.
При патологиях может увеличиваться содержание белков в моче, причем в зависимости от места повреждения в моче будет преимущественно повы-, шаться доля плазменных белков или белков клеток мочевыводящих путей. При воспалительных заболеваниях почек (гломерулонефриты) повышается проницаемость базальной мембраны клубочка нефрона; белка фильтруется больше, чем- обычно, и он не может целиком реабсорбнроваться. Нарушения реабсорбции белка в канальцах (нефрозы) приводят к тем же изменениям. В результате с мочой при гло- мерулонефритах и нефрозах может выделяться от 1 до 15—40 г белка в сутки. При повышенном содержании в плазме некоторых нормально фильтрующихся белков происходит большее выделение их с мочой..Но их количество в моче все равно незначительно и может быть выявлено только специальными методами. Например, если в крови увеличено количество некоторых __ ферментов, то они в ббльших количест-
' Сосуа Продукты вах фильтруются В МОЧу. ПОЭТОМУ В
|
распад Моче обнаруживается повышение активности ферментов, хотя это сущест- Рнс. 82 Схема регуляции карбокеипептида- венно не сказывается на общем содер- эой тонуса сосудов (по в. н. Ореховичу и др) жании белка, определяемого менее
чувствительными методами. Например, при панкреатитах наблюдается повышение активности а-амилазы, трипсина и в крови, н в моче.
Небелковые азотистые вещества мочи
Мочевина — главный азотистый компонент мочи. В норме ее выделяется 333— 583 ммоль в сутки {60—80% общего азота мочи). Повышенное выделение мочевины наблюдается при выраженном катаболизме белков и других азотистых компонентов (голодание, ожоги, травмы, атрофия тканей и т. д.). Пониженное выделение имеет место при поражениях печени (место образования мочевнны) и нарушении фильтрации плазмы в клубочках. В последнем случае происходит задержка мочевины в крови (азотемия). Низкое выделение мочевины бывает в ростовый период организма *и при действии анаболити- ческих препаратов.
Мочевая кислота. В норме количество выделяющей мочевой кислоты составляет 2, 35—5, 9 ммоль в сутки. Повышенное выделение ее с мочой отмечается при потреблении пищи, богатой нуклеиновыми кислотами, или при распаде клеток н тканей, например лейкоцитов у больных лейкозом. Повышенное содержание мочевой кислоты в моче обусловливается также повышенным синтезом ее в тканях организма (синдром Леша—Найхана у детей).
Креатинин. В норме с мочой выделяется около 4, 4—17, 6 ммоль креатини- на в сутки. Колебания зависят от развития мускулатуры. Креатинин экскрети- руется только у детей. У взрослых креатннурня — признак патологии (например, при мышечной дистрофии).
Аминокислоты. В норме с мочой выделяется примерно 0, 29—5, 35 ммоль аминокислот (по азоту) в сутки. Глицина, гистидина и аланнна в моче содержится больше, чем других аминокислот.
При патологии может наблюдаться гипераминоацидурия, например при ожогах, сахарном диабете, заболеваниях печени, мышечной дистрофии и т. д. При наследственной гипераминоацидурии имеет место дефект белков — переносчиков аминокислот в проксимальных канальцах почек. В результате наблюдается или повышенное выделение всех аминокислот (при общем дефекте транспортных систем канальцев), или отдельных групп аминокислот, (при дефекте одной из транспортных систем). При нарушении обмена аминокислот в тканях происходит выделение с мочой продуктов их обмена, не экскретирующихся в норме (гомогентизиновой кислоты — при алкалто- нурин, фенилпировиноградной, фенилуксусной, фенилмолочной кислое— при фенилкетонурии и т. д.).
Аммонийные соли. В норме с мочой выделяется около 30—60 ммоль аммиака в составе аммонийных солей (хлорида аммония) в сутки.
При патологии может наблюдаться повышенное их выделение с мочой (при заболеваниях, сопровождающихся ацидозом). Пониженная экскреция аммонийных солей проявляется при заболеваниях, сопровождающихся алкалозом, при употреблении с пищей большого количества щелочных веществ и-при заболеваниях почек, связанных с поражением дистальных канальцев, в которых происходит аммониогенез.
Гнппуровая кислота. Экскреция с мочой гиппуровои ч кислоты зависит только от количества принятой растительной пищи, так как эндогенно она не образуется. Обычно в суточной моче содержится до 5, 5 ммоль гиппуровой кислотй».
Индикан (индоксилсерная кислота). В норме моча содержит следы ин- дикана. Появляется он в ощутимых количествах при употреблении больших порций мясных продуктов и при гнилостных процессах в кишечнике.
Азотистые пигменты. В норме с мочой выделяется продукт распада гемпротеидов — стеркобилиноген, который превращается в стеркобилнн.
При патологии выделяются желчные кислоты и различные желчные пигменты, например, при поражениях печени и отравлении ядами, вызывающими гемолиз.
Безаэотнстые компоненты моч'и
Глюкоза и другие моносахариды. В норме суточная моча содержит всего 0, 3—1, 1 ммоль глюкозы. Эти количества не обнаруживаются обычными лабораторными методами, поэтому считается, что в нормальной моче глюкоза отсутствует. При употреблении с пищей такого количества углеводов, при котором концентрация глюкозы в крови достигает порогового значения, т, е порядка 8, 3—8, 8 ммоль/л, наблюдается пищевая глюкозурия.
При патологии имеет место глюкозурия, обусловленная или повышением содержания глюкозы в крови выше пороговых величин, или дефектом белка-переносчика, участвующего в реабсорбции ее в проксимальных канальцах почек. Первая причина наиболее часто встречается в клинике, например при сахарном и стероидном диабетах. Вторая вызывает так называемый почечный диабет. При поражении транспортных систем канальцев почек для других Сахаров, например фруктозы или пентоз (почечная фруктозурия или пентозурия), в моче обнаруживаются эти моносахариды.
Молочная и пировиноградная кислоты В норме суточная экскреция с мочой молочной и пировиноградной кислот составляет соответственно 1, 1 и 0, 11 ммоль. Повышенное содержание молочной кислоты в моче наблюдается при интенсивной мышечной работе и гипоксии. Увеличение экскреции пировиноградной кислоты с мочой имеет место при сахарном диабете, гиповитаминозе В,.
Кетоновые тела. В норме суточная моча содержит 20—50 мг кетоновых тел. Эти количества не обнаруживаются принятыми в клинике лабораторными методами. Увеличение их количества, т. е. кетонурия, наблюдается при сахарном диабете, голодании, стероидном диабете и т. д.
Минеральные соли. В норме суточная моча содержит (ммоль): натрия 174—222, калия 61—79, кальция около 4, 02—4, 99, неорганического фосфора около 33. Увеличение выведения с мочой натрия и уменьшение выведения калия наблюдается при гипофункции надпочечников, обратная картина — при гиперальдостеронизме и назначении минерало- и глюкокортикондов. Снижение содержания кальция в моче и выраженная фосфатурия наблюдается при введении больших количеств витамина D, паратирина, а высокая потеря кальция с мочой — при рахите, гнпопаратиреодизме.
Прикладная биохимия
йявщЧасть IV
| --2Н---» Н20 | |
§Ш
Ho, so-y> 4...... иди < ц> -он
ФАФ—S03H
ГЛАВА 31. ВВЕДЕНИЕ В КЛИНИЧЕСКУЮ БИОХИМИЮ
Биохимические знания, приемы и методы являются основой диагностики, лечения и профилактики заболеваний, они также используются в различных областях фармации биофармации, биотехнологии лекарств, анализе, контроле качества и стандартизации лекарственных препаратов.
1. Цель и задачи клинической биохимии
Клиническая биохимия — это прикладной раз- • дел биохимии, изучающий состояние биохимических процессов в организме человека для выяснения механизма развития болезни и _ оценки состояния его здоровья. Клиническая биохимия является составной частью практической медицины (табл. 36). Однако возможности изучения причины, т. е. этнологии, забо левания и механизма его развития, т. е. пато 'генеза, с помощью биохимических методов клетках, тканях и органах человека весьма ог раничены и составляют малую часть клинико биохимических исследований, так как эти ис следования необходимо проводить не в ущер.б че ловеку. Поэтому в клинике биохимические ла бораторные исследования используются основном для оценки состояния здоровья чело века; этиологию и патогенез обменных наруше нин изучают на моделях заболеваний в эксперименте. Эту задачу выполняет патологическая биохимия, или патобиохимия, на данных которой основываются знания клинической биохи мии.
Процесс жизнедеятельности организма определяют три взаимосвязанных признака — структура, обмен веществ и функции, каждый из которых составляет предмет изучения разных специальных дисциплин. Лечение и про-
Таблица 36 Разделы биохимик в медицинском образовании
|
филактика заболеваний основывается на знании биологии и социальных условий жизни человека.
Назначение клинико-бнохимических исследований:
1) ранняя диагностика и постановка дифференциального диагноза заболевания;
2) характеристика течения и прогноза заболевания;
3) контроль эффективности лечебных и профилактических мероприятий:
4) изучение молекулярных механизмов развития заболевания
Материалом для клинико-биохимических исследований служат:
1) биологические жидкости внутренних сред организма: кровь, спинномозговая жидкость, лимфа, внутрисуставная и внутриглазная жидкости;
2) экскреты: моча, желчь, слюна, желудочный и кишечный соки, кал, nui, слезная жидкость, женское молоко и молозиво, семенная жидкость, слизистые выделения;
3) кусочки ткани или биоптаты, т. е. взятые прижизненно с помощью специальных инструментов или во время хирургических вмешательств.
Наиболее частым объектом биохимических исследований в клинике являются кровь и моча; реже анализируются другие жидкости и экскреты, а также ткани человека.
Основные группы биохимических показателей, определяемых в клинике:
!) содержание макромолекул, мономеров и некоторых продуктов их обмена;
2) активность ферментов и изоферментов;
3) содержание витаминов, коферментов и продуктов их обмена;
4) содержанке воды и минеральных веществ;
5) содержание внеклеточных регуляторов-гормонов, гормоиоидов, нейро- медиаторов, гуморальных регуляторов и продуктов их обмена.
2. Тактика биохимических исследований в клинике
Применение биохимических методов в клинике позволяет Не только выявить отклонение биохимического показателя и тем самым облегчить постановку диагноза заболевания, но и понять механизм развития обменных нарушений и функций организма. Причиной нарушений биохимических процессов могут быть генетические н негенетические (внешние) факторы. Генетические нарушения могут быть первичными, вызванными спонтанными мутациями, и вторичными, наступающими под действием внешних факторов. Внешние факторы, вызывающие патологию, весьма многообразны: пищевые, физические, химические, механические, биологические (инфекционные и неинфекционные), психогенные.
В основе патогенеза многих заболеваний лежат: патология переноса генетической информации и биосинтеза белка, патология метаболизма,. патология мембран, патология регуляций. Последующие биохимические нарушения функций клеток, тканей и органов и систем организма являются, как правило, следствием перечисленных начальных изменений.
Тактика клинико-биохимических исследований включает ряд этапов:
1) биохимический скрининг (просеивание), т. е. выявление, часто случайное, отклонений от нормы при профилактическом лабораторном обследовании Населения;
2) целенаправленное дифференциально-диагностическое биохимическое исследование для установления точного диагноза,
3) использование наиболее информативных биохимических тестов для контроля проводимого лечения;
4) биохимический контроль за состоянием выздоровления и восстановления нарушенных функций (диспансерное наблюдение)
На каждом из этих этапов объем, сочетание и частота исследования соответствующих биохимических показателей, необходимость их определения в конкретной биологической жидкости, экскрете или биоптате обусловливается поставленными целями.
.3. Принципы биохимической диагностики заболеваний и примеры их использования в практике
Биохимическая диагностика заболеваний основывается на знании:
а) общих закономерностей метаболизма в органоидах клетки;
б) структурно-функциональных особенностей клеточных мембран и гисто- гематических барьеров;
в) биохимических особенностей специализированных тканей и органов;
г) особенностей нейро-эндокринной регуляции обмена веществ.
Знание закономерностей метаболизма клетки позволяет оценить состояние путей обмена, общих для любой клетки, независимо от ее специализации {путей распада питательных веществ и энергетики, синтеза белка и т. д.), а также вероятность нарушения биохимических процессов в отдельных внутриклеточных структурах, где локализовано определенное звено обмена. Знание структурно-функциональных особенностей клеточных мембран может быть использовано при выявлении дефектов транспорта веществ {например, используя нагрузку какими-либо веществами и затем определяя динамику их содержания) и проницаемости клеточных мембран, а в масштабе ткани — гисто-гематических барьеров. Особенности обмена веществ в специализированных тканях и органах дает возможность выявить избирательность их повреждения, используя наиболее специфичные для них биохимические тесты. Наконец, знание нейро-эндокринных механизмов регуляции обмена веществ ориентирует врача на применение биохимических методов определения соответствующих регуляторов {гормоны, медиаторы и их метаболиты) в организме.
В клинике редко приходится использовать биоптаты различных тканей, т. е. непосредственно выявлять биохимические нарушения в органах, пораженных патологическим процессом. Биохимические исследования таких жидких сред, как кровь и моча {наиболее часто подвергаемых биохимическому анализу) требуют инбй, чем прямое изучение тканей, оценки полученных изменений. Дело в том, что изменения биохимических показателей в жидких средах лишь косвенно отражают сдвиги в отдельных тканях и органах. К тому же, например, в крови они представляют собой равнодействующую двух противоположных явлений — поступления в кровь данного компонента и его утилизации тканями. Большинство низкомолекулярных веществ легко проходят через клеточную мембрану, поэтому, определяя содержание этих веществ в крови, можно говорить об интенсивности процессов их образования и использования в тканях. Низко молекулярные вещества, аккумулирующиеся в клетках, поступают в кровь и выделяются с мочой при нарушениях проницаемости клеточных мембран.
Широко используется в клинической практике определение содержания в крови различных белков, поступающих из тканей. Особенно часто определяется активность ферментов, методы регистрации которых очень чувствительны и позволяют обнаружить минимальные отклонения. К тому же ферменты имеют определенную органную и тканевую специфичность. Поэтому повышение их активности в крови свидетельствует о повреждении патологическим процессом соответствующего органа или ткани, так как происходит освобождение ферментов я KpoRh ич отмиряюших клеток или просто потеря ферментов (как и других веществ) клетками вследствие повышенной проницаемости их плазматических мембран. Еще более наглядно использование в диагностике методов определения состава изоферментов крови. Многие ткани и органы существенно различаются по набору изоферментов. Поэтому изменение состава изоферментов (для выявления которых в клинике используются методы электрофореза в гелях) в плазме крови более специфично и прояв ляется раньше, нежели повышение общей активности данного фермента.
В арсенале врача имеется много биохимических методов, применение которых зависит от предполагаемого диагноза. Тактика обследования и использования биохимических методов при молекулярных болезнях (генетических протеинопатиях) и приобретенных заболеваниях различна.
Биохимическая диагностика молекулярных болезней зависит от вида про- теинопатин, т. е. от того, является заболевание ферментопатией или неферментной протеинопатией.-Тактика биохимической диагностики ферментопатий состоит в.том, чтобы после обнаружения (часто случайного) повышенного содержания метаболитов в крови и моче, накопления или отсутствия некоторых макромолекул в клетках крови (чаще всего в лейкоцитах) и биоптатах тканей направить исследования на выявление дефектного фермента в биоптатах н клетках крови. В ряде случаев эти биохимические исследования заканчиваются выделением дефектного фермента, изучением его свойств, а следовательно, установлением максимально точного диагноза и патогенеза заболевания.
Биохимическая диагностика неферментных протеинопатий осуществляется путем обнаружения дефектного белка и последующего изучения его свойств и структуры.
Биохимическая диагностика заболеваний, вызывающих повреждение определенных органов. В патогенезе многих заболеваний имеет место нарушение проницаемости плазматических мембран и гисто-гемэтических барьеров или отмирание участка органа. В этих случаях используют методы ферментной диагностики заболеваний.
Болезни, вызывающие повреждение мышечных органов. Примером таких заболеваний может служить ишемическая болезнь сердца, при которой происходит некроз участка сердца (инфаркт миокарда). Для диагностики ее используется определение активности креатинфосфокиназы (К.ФК), аспарта- таминотрансферазы {ACT) и лактатдегидрогеназы (ЛДГ), так как эти ферменты содержатся в мышечной ткани и, в частности, в миокарде в больших количествах. Динамика изменений их активности в плазме крови при инфарк
те миокарда показана на рис. 83. Уже через Э ч после инфаркта повышается активность КФК в плазме крови; она достигает максимума через 24 ч. Несколько позже начинает повышаться и достигает максимума активность ACT и ЛДГ". Степень гиперферментемии зависит от размеров инфарктного очага: чем он больше, тем выше подъем активности этих ферментов в плазме крови. Еще более специфична диагностика при определении изоферментов КФК и ЛДГ в плазме крови. Определение спектра этих изоферментов позволяет дифференцировать поражение Рис. S3. Диаграмма изменений активности фер- мышечной ткани и избежать ошибок ментов s крови при инфаркте миокарда в постановке диагноза. Так, например, аналогичное повышение КФК и ЛДГ бывает и при поражении скелетных мыши, однако нзоферментный состав КФК и ЛДГ в разных органах различен. КФК — димер, состоящий из двух субъединиц — М и В. Всего имеется три типа изофермента КФК: КФК( (ВВ) характерен для ткани головного мозга, КФКг (MB) —для сердца и КФКз (ММ) —для скелетной мышцы.
Поэтому повышение в плазме крови активности КФКг (Тип MB) свидетельствует об инфаркте миокарда (даже вычисляют математически размеры инфарктного очага по степени повышения активности КФКг в плазме крови), а КФКз—0 повреждении (например, атрофии) скелетной мышцы.
Другой прийер — определение изоферментного спектра ЛДГ плазмы. Изоферменты ЛДГЬ ЛДГ2 преобладают в сердце, ЛДГ3 — в поджелудочной железе и некоторых других железах, ЛДГ4 и ЛДГ5 — в схелетной мышце и печени. Прн инфаркте сердца в плазме крови увеличивается доля изоферментов ЛДГ, и ЛДГг, при поражении скелетных мышц и печени — ЛДГ4 и ЛДГ5.
При поражениях печени используют определение ее «органоспецифи- ческих» ферментов; аланинаминотрансферазы (АЛТ), глутаматдегидрогеназы (ГлДГ), щелочной фосфатазы (ЩФ), изоферментов ЛДГ в плазме крови. В крови увеличивается активность АЛТ в 8—10 раз, ГлДГ — в 10—15 раз, ЩФ — в 2—3 раза и, как уже говорилось, повышается содержание ЛДГ4 и ЛДГ5.

|
При поражениях поджелудочной железы в плазме крови резко повышается активность органоспецифическнх ферментов — а-амилазы, трипсина и фосфолипаз. Наиболее часто используется определение активности а-амилазы в крови и моче. При острых панкреатитах активность амилазы в крови повышается через 3—6 часов и достигает максимума через 48 --72 часа; в моче увеличивается активность фермента через 6—10 часов. Активность амилазы в крови при остром процессе может повышаться в 40 раз; при хроническом в 2—3 раза.
Биохимическая диагностика болезней регуляции: Диагностика этих заболеваний основывается почти исключительно на биохимических исследованиях С этой целью проводится прямое определение предполагаемого внеклеточного регулятора и продуктов его обмена, которое подкрепляется исследованием содержания регулируемых метаболитов в крови и моче. Например, при диагностике сахарного диабета определяется содержанием глюкозы, кетоновых тел в крови и моче; окончательно диагноз сахарного диабета устанавливается по концентрации инсулина в крови.
4. Клинико-биохимические лаборатории
место в работе клиник ^" 'поликлиник. Объем и номенклатура биохимических лабораторных исследований в них зависит от типа медицинского учреждения.
В настоящее время Всемирная организация здравоохранения обсуждает номенклатуру лабораторных исследований, включающих до 800 наименований. В СССР проводится работа по унификации лабораторных методов, осуществляются разработка и выпуск готовых наборов по определению биохимических показателей. Особое внимание уделяется внедрению экспресс-методов биохимического анализа, которые удобно применять на начальных этапах обследования населения (биохимическом скрининге) и службе скорой медицинской помощи.
Самый большой эффект дает автоматизация биохимических исследований. В настоящее время применяют три вида биохимических автоматов: одноцеле- вые (для определения одного компонента, например глюкозы, кальция и т. д.); групповые (для определения группы родственных соединений, например аминокислотный анализатор применяют для определения свободных аминокислот) и многоцелевые (для одновременного определения самых разнообразных показателей — субстраты, ферменты и т. д.).
ГЛАВА 32. ФАРМАЦЕВТИЧЕСКАЯ БИОХИМИЯ
Фармацевтическая биохимия представляет собой совокупность биохимических знаний, используемых в решении задач фармации. Биохимические исследования необходимы при разработке рациональных лекарственных форм, стандартизации и контроле качества лекарств, анализе и производстве лекарственных средств, поиске новых лекарственных средств и оценку эффективности на основе изучения их метаболизма. В решении этих задач биохимия теено сотрудничает с фармацевтическими науками: с технологией лекарств — в области биологического обоснования конкретных лекарственных форм для данного лекарственного средства или их комбинации; с фармацевтической химией — в вопросах обоснования биохимических методов стандартизации и контроля качества лекарств, анализа и синтеза лекарственных веществ; о фармакологией и токсикологией — в вопросах метаболизма лекарств и ядов. Каждое новое лекарственное вещество, облеченное в определенную лекарственную форму, требует.всесторонних исследований, рассматривающих поведение его в организме. Создание общей теории метаболизма лекарства в организме фактически основывается на деятельности ферментных систем на различных этапах контакта лекарства с организмом и специфического взаимодействия с природными процессами регуляции. Роль биохимии в этих вопросах неоценима. Знание особенностей ферментативных превращений лекарств в организме позволяет обосновать целесообразность использования определенной лекарственной формы для эффективного влияния препарата на определенный орган или ткань, вскрыть причины неадекватного эффекта его и помочь оценить действующее начало лекарств.
Все лекарственные средства делят по отношению к организму человека на природные (аутобиогенные) и чужеродные (ксенобиотики). Природные являются естественными продуктами организма и участвуют в осуществле нии биохимических процессов. Ксенобиотики в норме отсуствуют в организме человека или находятся б следовых количествах. Они являются синтетическими соединениями или веществами, извлеченными из других организмов (главным образом' микроорганизмов и растений). Формально вещества, являющиеся для человека витаминами, сходны с чужеродными, но они, не обра зуясь в организме человека, обязательны для осуществления его биохимических реакций. Поэтому их тоже следует отнести к природным препаратам.
1. Биохимические методы, используемые в стандартизации и контроле качества лекарств
Стандартизация и контроль качества лекарств являются важной стороной деятельности фармацевтической службы. Для стандартизации препаратов природного происхождения, относящихся по своему действию к группе биорегуляторов (гормоны, гормоноиды, витамины), используются химические и биологические способы стандартизации. Обычно биологическая стандартизация заменяется химической, если разработаны точные физико-химические методы определения данных препаратов. Однако для ряда препаратов, например, белковых гормонов, приемлема только биологическая стандартизация, поскольку, определяя химическими методами содержание этих гормонов в образцах препаратов, нельзя дать оценку их биологической активности. Так, стандартизация инсулина проводится по снижению им содержания глюкозы в крови, кальциотонина — по снижению содержания кальция в крови, а паратирина — по его повышению. Биохимические методы применяют и для стандартизации препаратов тропных гормонов. Активность кортикотропина устанавливают по снижению им количества аскорбиновой кислоты и холестерина в надпочечниках, соматотропина — по включению сульфата в хрящи н т. д. В фармацевтической промышленности эти биохимические методы позволяют контролировать качество выпускаемых препаратов, а в системе аптечной службы — контролировать качество препаратов в процессе их хранения.
Государственная система контроля качества лекарств предусматривает наблюдение за всеми этапами испытания и внедрения новых лекарств — доклиническим (экспериментальным) и клиническим. На каждом из этих этапов для оценки эффективности специфической активности, побочного действия и клинической эффективности лекарств проводят различные биохимические исследования.
2. Ферменты как аналитические реагенты
В фармацевтической промышленности, аналитической химии и медицине широко применяются в качестве аналитических реагентов иммобилизованные ферменты. Для ферментного анализа веществ характерны безвредность и высокая специфичность.
Иммобилизованные ферменты применяют в автоматическом анализе биологических субстратов и лекарственных веществ. Они являются рабочей частью автоматических проточных анализаторов. Жидкость, в которой находится определяемое вещество, протекает по специальным трубкам, к внутренней поверхности которой «пришит» фермент.
Субстрат количественно превращается ферментом, что регистрируется по изменению оптической плотности или флуоресценции жидкости. Оптически активными являются коферменты оксидоредукта?, например НАД, НАДФ, ФАД, ФМН. Таким способом определяют содержание субстатов, которые могут подвергаться превращению оксидоредуктазами.
Для аналитических целей используются специальные ферментные электроды. Они представляют собой электрохимические датчики, на которые нанесен слой иммобилизованного фермента. Чаше всего для ферментных электродов изготовляются ферменты, иммобилизованные в полиакриламидный гель. При контакте анализируемого вещества с ферментом электрода происходит реакция. Продукт (или субстрат) реакции как электрохимически активное вещество изменяет окислительно-восстановительный потенциал. По изменению потенциала судят о количестве анализируемого вещества в среде. Ферментные электроды позволяют проводить непрерывный анализ веществ.
На основе проточных анализаторов с иммобилизованными ферментами и ферментных электродов разработаны биохимические автоматы. С их помощью налажено автоматическое определение многих веществ: мочевины, глюкозы, этанола, лактозы, лактата, пирувата, аспарагина, глутамина и других в биологических жидкостях. Разработан метод быстрого определения пенициллина в ходе промышленного производства и в фармацевтических препаратах. Метод основан на использовании иммобилизованной на пористом стекле пенициллиназы, которая гидролизует в образцах пенициллин. Образующаяся пенициллииовая кислота определяется потенциометрическн.
Иммобилизованные ферменты используют для непрерывного контроля загрязненности окружающей среды токсическими препаратами. Например, определение фенола в сточных водах и других средах ведется с помощью иммобилизованной тирознназы.
Широкое применение получили методы иммуноферментного анализа для определения природных лекарственных веществ н ксенобиотиков. Суть его состоит в том, что молекула фермента, «пришитаяж антигенуили антителу, служит индикатором высокоспецифической реакции антиген—антитело в среде. Измеряя активность фермента, можно сказать, сколько молекул антигена вступило в иммунохимнческую реакцию с антителом. Например, для того чтобы определить количество инсулина, вначале получают антитела к нему, связывают их с нерастворимым носителем. К инсулину, как к антигену, пришивают фермент, затем добавляют в среду инсулин (без фермента), количество которого надо измерить, и инсулин с ферментом, количество которого точно известно. Оба инсулина конкурируют за места связывания с иммобилизованными антителами. Определяя по ферментной реакции количество индикаторного инсули на (с ферментом), связывавшегося с антителами или оставшегося в растворе, измеряют количество инсулина в анализируемой жидкости. Метод нммунофер- ментного анализа успешно применяют для определения ряда ксенобиотиков (кодеина, морфина, барбитуратов и др.) в крови и моче. Задача состоит в том, чтобы получить антитела к этим ксенобиотикам.
3. Биотехнология лекарственных препаратов
Применение ферментов в фармацевтической промышленности. Иммобилизованные ферменты нашлн применение п химико-фярмапевтической промышлен-i ности для синтеза лекарственных средств. Ферменты позволяют быстро, специфично и без побочных продуктов (которые, являются бичом химического синтеза) осуществлять синтез веществ. Так, иммобилизованная пенициллинамидаза используется для промышленного получения б^амнно-пеиициллановой кислоты, являющейся исходным сырьем в производстве полусинтетических новых пенициллинов широкого спектра действия и цефалоспоринов. Промышленное производство гормональных препаратов — кортизола и преднизолона — осуществляется с помощью колонок, заполненных гранулами нерастворимого носителя с иммобилизованными ферментами. Исходное вещество, поступающее в колонку, — предшественник кортизола — соединение «S* Рейхштейна> которое превращается иммобилизованной 11- р-стероидги дроксилазой в кортизол (гидрокортизон), вытекающий из колонки- реактора. Из кортизола с помощью иммобилизованной Д|-2-стероиддегидро- геназы получают преднизолон.
Генно-инженерная биотехнология лекарственных средств. Этот способ производства лекарственных препаратов в настоящее время освоен в лабораторных условиях и внедряется в фармацевтическую промышленность. Методы генной инженерии могут быть использованы только для получения белковых и пептидных препаратов. Пересадкой генов, кодирующих образование инсулина, соматостатина, соматотропина и других белково-пептидных гормонов, в кишечную палочку были получены в культуральной жидкости продукты деятельности пересаженных генов, т. ё. соответствующие белковые препараты. Особую ценность представляет разработка промышленной биотехнологий производства инсулина, требующегося во все возрастающих количествах. Возможность его получения традиционным способом — из поджелудочных желез крупного рогатого скота — ограничена, а химический синтез, осуществленный в лабораторных условиях, трудоемок и пока несовершенен.
Большой интерес для фармацевтической промышленности представляет новый способ биотехнологии нммуноп реп аратов — антител, интерферона. Он основан на получении клеточных гибридов, которые могут производить антитела в пробирках. Для этой цели были-взяты клетки селезенки, продуцирующие антитела, но неспособные Долго жить в пробирке, и клетки опухолей, которые хорошо живут и размножаются в искусственной среде. Из них получены клеточные гибриды, т. е. клетки, получившиеся не вследствие деления, а в результате слияния. Эти клеточные гибриды, названные гибридомами, унаследовали от клеток' селезенки способность синтезировать антитела, а от опухолевых клеток — быстро размножаться в искусственных условиях Весь процесс получения препаратов чистых антител и интерферона упрощает- 442 ся. Животным вводят соответствующие белковые вещества (иммунизируют) или заражают вирусом (для производства интерферона), берут от них клетки селезенки, получают гибридомы и соответствующие иммунопрепараты. В настоящее время многие фармацевтические фирмы производят иммунопрепараты подобным способом.
4. Биохимические основы технологии лекарственных форм
Оптимальное действие лекарственного вещества на организм зависит от лекарственной формы, в которой оно применяется. Одним из условий выбора.лекарственных форм при использовании любого лекарственного вещества является знание условий биологйческой среды, с которой контактирует вводимое лекарство, т. е. ферментного состава и физико-химических свойств биологических жидкостей ротовой полости, желудка и кишечника (для энтеральных лекарственных форм) и внутренних сред организма (для парентеральных лекарственных форм).
Методические приемы биохимии использованы и при разработке новой лекарственной формы — липосомы. Липосомы — это микроскопические пузырьки, стенка которых представляет собой двухслойную липидную мембрану. Их используют в биохимических исследованиях как простейшую модель биологических мембран. Возникла заманчивая идея — использовать липосомы как лекарственную форму для транспорта лекарственных веществ. Липосома, подобно контейнеру, загружается различными лекарственными средствами, например ферментами, гормонами, антибиотиками, цитостатиками и Др., и вводится в кровеносное русло. Возможны два пути проникновения в клетки липосом с препаратом: эндоцитоз или «слияние» лнпидной оболочки липосомы с липидным слоем мембран клеток. В первом случае липидная оболочка липосом внутри клеток разрушается фосфолипазами лизосом и лекарство освобождается в цитоплазму, во втором липидный компонент липосом входит в состав клеточных мембран, а его лекарственное содержимое поступает в цитоплазму. Липосомы делают возможным транспорт в клетки водорастворимых препаратов, в том числе макромолекул, которые в обычных условиях не проникают через плазматическую мембрану. При парентеральном введений липосомы'захватываются клетками ретикуло-эндотелиальной системы, прежде всего селезенки и печени; в остальные органы и ткани их поступление невелико. Чтобы повысить избирательность действия препаратов, заключенных в липосомы, в липидную оболочку липосом встраивают молекулы, являющиеся антителами к антигенам определенных органов. Эти антитела на поверхности липосом находят путь к нужному антигену органа, к которому необходимо доставить лекарство. Этим достигается избирательность действия препарата, снижается его побочное влияние на другие ткани и требуется гораздо меньшая доза вещества для получения лечебного эффекта. В частности, были использованы антитела к коллагену, которые встраивались в липосомы. Коллаген обнажается при слущивании эндотелия сосудов или их повреждении, поэтому, целесообразно антитела к коллагену использовать для доставки веществ, влияющих'на сосуды или на тромбы в них.
5. Метаболизм лекарств и ядов
Все вещества, поступающие в организм различными 'путями, проходят в нем ряд сходных этапов—всасывание, распределение (механический транспорт) и выделение. Скорость прохождения веществ зависит от особен ноете Й их строения и физико-химических свойств, а также от сродства к различным биологическим молекулам, что облегчает или замедляет скорость прохождения этих этапов. Учение, описывающее скорость протекания различных этапов, которое проходит поступающее в организм вещество, называют хемобио- кинетикой (т. е. движением химических веществ в живом организме). Хемо- биокинетика включает три группы понятий — фармакокинетику, токсико- кинетику и биокинетику. Фармакокинетика ограничивается рамками изучения лекарственных, веществ, токсикокинетнка — токсических веществ и биокинетика — естественных для организма веществ. Разделение это во многом условно, поскольку граница между лекарствами и ядами часто стирается Более того, даже аутобиогенные вещества в зависимости от дозы могут оказаться токсическими.
На судьбу веществ в организме существенное влияние оказывает скорость их превращения различными ферментами, т. е. металлической трансформации. Метаболизм биогенных веществ и ксенобиотиков, используемых как лекарства, по существу, сводится к закономерностям ферментативной кинетики. Биогенные вещества, являясь естественными субстратами ферментов, превращаются со скоростями, характерными для каталитических свойств данных ферментов. Метаболическая судьба ксенобиотиков зависит от наличия ферментов, которые способны катализировать их превращение. Если ферменты, катализирующие превращения данных ксенобиотиков, отсутствуют, то такие ксенобиотики метаболически инертны. Их судьба в организме описывается только процессами всасывания, транспорта и выделения. Ферменты, катализирующие превращение ксенобиотиков, должны быть малоспецифичными по отношению к субстрату, поскольку данный субстрат относится к категории чужеродных. Очевидно, в процессе эволюции ферменты с высокой специфичностью стали основой собственного метаболизма живых организмов, а ферменты с низкой специфичностью по отношению к субстрату стали своеобразным орудием защиты по инактивации чужеродных веществ.
Биохимия изучает ферментативные превращения лекарственных веществ в организме, используя для этого соответствующие методы. Метаболизм лекарств в организме можно изобразить в виде общей схемы:
Лекарство------ Метаболиты ► Продукты метаболизма
Метаболизм лекарств изучают путем определения лекарственных веществ и их метаболитов в биологических жидкостях, тканях к экскретах, а также активности и кинетики ферментов, участвующих в метаболизме лекарств.
В экспериментах используют оба подхода к изучению метаболизма ксенобиотиков. В клинике, как правило; метаболизм лекарственного вещества оценивают по содержанию в крови, моче и других экскретах вводимого лекарства и его метаболитов.
|
|