
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Механизм сопряжения дыхания и фосфорилирования в митохондриях 6 страница
|
|
4. Патология липидного обмена
Наиболее часто патология липидного обмена проявляется в виде ги- перлипемий {повышенное содержание липидов в крови) и тканевых липидо- зов {избыточное отложение липидов в тканях). В норме содержание липидов в плазме крови следующее: общие липиды — 4—8 г/л; триглнцериды — 0, 5—2, 1 ммоль/л; фосфолипиды общие — 2, 0—3, 5 ммоль/л; холестерин общий— 4, 0—10, 0 ммоль/л (Уз от общего составляет эфиросвязанный холестерин).
Гнперлипемия может проявляться в повышении концентрации всех липидов или отдельных их групп. Например, в форме гиперхолестеринемии, гипертриглицеридемии и т. д. Поскольку практически все липиды плазмы крови входят в состав липопротеидов, то гиперлипемии могут быть сведены к одной из форм гиперлипопротеинемий, каждая из которых отличается соотношением разных классов липопротеидов плазмы.
Различают экзогенные, или пищевые, гиперлипемии, которые представляют собой нормальное повышение содержания липидов'в крови после приема жирной пищи, и эндогенные, являющиеся следствием нарушения обмена липидов. Причиной эндогенных гиперлипемий может быть первичный наследственный дефект апопротеинов либо фермента липидного обмена. Однако чаще бывают гиперлипемии, вызванные вторичными причинами — нарушениями регуляции липидного обмена, действиями внешних вредных факторов и т. д. Выделяют 5 типов первичных гиперлипопротеинемий.
Гиперлипопротеинемия I типа характеризуется повышенным содержанием хиломикронов в плазме крови; в то же время может быть понижено количество а- и p-липопротеидов. Содержание триацилглицеринов в 8—10 раз выше нормы, а уровень холестерина не повышен. Возможно, при этом заболевании имеет место дефект липопротеидлипазы, разрушающей хиломикроны.
Гиперлипопротеинемия II типа. Проявляется в виде повышенного содержания в плазме крови p-липопротеидов и соответственно в 1, 5—2 раза более высокой, чем в норме, концентрацией холестерина. Описана наследственная форма этого заболевания, связанная с образованием дефектного апопротеина р-липопротеидов и более замедленным их распадом в тканях.
Гиперлипопротеинемия III типа. Редкое наследственное заболевание, характеризующееся образованием необычной формы p-липопротеида. Содержание холестерина и триацилглицеринов у этих больных иногда в 2—5 раз превышает норму.
Гиперлипопротеинемия IV типа. Характеризуется увеличением пре-р-ли- попротеидов и повышенным содержанием (в 2—5 раз) триацилглицеринов в плазме крови. Встречается часто у лиц пожилого возраста. Описаны и наследственные формы этого заболевания.
Гиперлипопротеинемия V типа. При этой патологии у больных повышено содержание хиломикронов, пре-р-липопротеидов, триацилглицеринов и холестерина в плазме крови.
Вторичные гиперлипопротеинемий, возникающие вследствие нарушений метаболизма липидов в тканях или его регуляции, йаблюдаются при сахарном диабете, гипофункции щитовидной железы, алкоголизме и т. д.
Тканевые липидозы. Гиперлипопротеннемии могут привести к тканевым липидозам. Они возникают также в результате наследственных дефектов ферментов, участвующих в синтезе и распаде липидов в тканях. Остановимся на некоторых примерах тканевых лнпидозов.
Атеросклероз — широко распространенная патология, характеризующаяся отложением главным образом холестерина в стенках сосудов. Липидные бляшки — это своеобразное инородное тело, вокруг которого развивается соединительная ткаиь (склероз). Наступает кальцификация пораженного участка сосуда. Сосуды становятся неэластичными, плотными, ухудшается кровоснабжение тканей, а на месте бляшек могут возникать тромбы.
Атеросклероз развивается в результате гиперлипопротеннемии. В стенку сосуда проникают все липопротеиды, кроме хиломикронов. Однако а-липо- протеиды, содержащие много белка и фосфолипидов, могут быстро распадаться в стенке сосуда или из-за малых размеров удаляться из нее. Атерогенными являются. Р" липопротеиды и частично пре-p-липопротеиды, содержащие много холестерина. При повышении этих классов липопротеидов в крови и увеличении проницаемости сосудистой стенки происходит пропитывание сосудов атерогенными липопротеидамн с последующим развитием атеросклероза.
Жировая инфильтрация печени. При этой патологии содержание триглн- церидов в печени в 10 раз выше нормы. Скопление жира в цитоплазме клеток вызывает нарушение функции печени. Причины могут быть разные, одна из них — недостаток липотропных факторов н связанный с этим избыточный синтез триглицеридов.
Кетоз — патологическое состояние, обусловленное накоплением кетоновых тел в организме. Его можно лишь условно рассматривать как патологию метаболизма липидов, поскольку избыточный биосинтез кетоновых тел в печени возникает при интенсивном сгорании в ней не только жирных кислот, но и кетогенных аминокислот. В ходе распада углеродных скелетов этих аминокислот образуются ацетил-КоА и ацетоацетил-КоА, используемые и кетогенезе. Кетоз сопровождается кетонемией и кетонурией, т. е. повышением содержания кетоновых тел в крови и выделением их с мочой. При тяжелых формах • кетоза содержание кетоновых тел в крови может повышаться до 10—20 ммоль/л. В суточной моче в норме имеются следы кетоновых тел, при патологии с мочой может выделяться за сутки от 1 до 10 г и даже более кетоновых тел. Кетонемия и кетонурия наиболее часто наблюдаются при сахарном диабете (выраженность кетоза зависит от тяжести этого заболевания), а также при длительном голодании, «стероидном» диабете.
5. Применение липидов и их компонентов в качестве лекарственных препаратов
Для применения в клинике разработаны жировые препараты эмульсий для парентерального введения. Посяольку они вводятся больным в вену, размер эмульсионных частиц жира не должен превышать размеры наиболее крупных естественных липопротеидов — хиломикронов, т. е. примерно 1 мкм.
Разработаны жировые эмульсии подобного типа из кукурузного масла {препарат липомаиз), из хлопкового (липофундин и липомоль), из соёвого масла (интралипид). Эти препараты содержат от 10 до 20% липидов, эмульгаторы (фосфатиды и другие вещества), иногда глицерин. Применяются для повышения энергетических ресурсов организма у ослабленных больных. Кроме того, липотропные препараты {метионин, холин, инозит), являющиеся компонентами природных фосфолнпидов, применяются для профилактики жировой инфильтрации печени.
ГЛАВА 19. ОБМЕН АМИНОКИСЛОТ Н БЕЛКОВ
Аминокислоты — основной источник азота для организма млекопитающих, поэтому они являются связующим звеном между процессами распада и синтеза азотсодержащих соединений. За сутки в организме взрослого человека обновляется до 400 г белка. Разные белки обновляются с разной скоростью — от нескольких минут до 10 и более суток. А такой белок, как коллаген, почти не обновляется. В целом полупериод распада всех белков человеческого организма составляет около 80 сут. Причем необратимо распадается четвертая часть белковых аминокислот (около 100 г), которая должна возобновляться за счет пищевых аминокислот и частично синтезируемых эндогенных аминокислот.
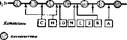
Внутриклеточное содержание свободных аминокислот невелико и в обычных условиях жизнедеятельности относительно постоянно. Это говорит о том, что в клетках поддерживается некий стационарный уровень аминокислот, или фонд свободных аминокислот, который отражает интенсивность процессов поступления и расходования аминокислот (рис.-55).
Существует несколько путей поступления свободных аминокислот, образующих аминокислотный фонд в клетке.
I. Транспорт аминокислот из внеклеточной жидкости (наблюдается,
Пути поступления
«*- Синтез белков и пептидов
| Транспорт внеклеточных — аминокислот |
| Синтез небелковых азотсодержащих соединений Синтез коныогатов |
| Синтез незаменимых — аминокислот |
| I Синтез углеводов (глюконеогенез) |
~~Синтез липидов
Распад белков —ч»
Окисление до конечных продуктов (мочевина,
С02, н20)
Рис. 55. Схема процессов, влияющих на фонд аминокислот в клетках
как правило, при всасывании пищевых аминокислот). Аминокислоты проникают внутрь клетки путем вторичного активного транспорта за счет энергии градиента ионов натрия на мембране. Перенос осуществляется с помощью пяти транспортных систем (белков-переносчиков), рассмотренных прн описании всасывания аминокислот в кишечнике.
2. Образование заменимых аминокислот.
3. Внутриклеточный гидролиз белков. Это основной путь поступления аминокислот.
Пути потребления аминокислот, способствующие снижению их внутриклеточного уровня:
1) синтез белков и пептидов—основной путь потребления аминокислот;
2) синтез небелковых азотсодержащих соединений — пуринов, пирими- дннов, порфиринов, холина, креатина, меланина-, некоторых витаминов, коферментов (никотинамид, фолиевая кислота, кофермент А), тканевых регуляторов (гистамин, серотонин), медиаторов (адреналин, норадреналин, ацетил- холин);
3) синтез углеводов (глюконеогенез) с использованием углеродных скелетов аминокислот;
4) синтез липидов с использованием ацетильных остатков углеродных скелетов аминокислот;
5) окисление до конечных продуктов обмена. Этот путь служит для извлечения энергии при распаде аминокислот.
1. Распад белков до аминокислот в тканях
Первой стадией обновления белков является их гидролиз с помощью тканевых протеиназ, или катепсинов. Катепсины сосредоточены преимущественно в лизосомах, как и многие другие гидролитические ферменты. Однако катепсины имеются и в других частях клетки: гиалоплазме, митохондриях, эндопл аз магическом ретикулуме. Лизосомальные катепсины наиболее активны в кислой среде, поэтому их называют кислыми катепсинами. В цитоплазме и других частях клетки катепсины проявляют свое оптимальное действие в нейтральной и слабощелочной среде.
Белок, подвергающийся гидролизу, взаимодействует сначала с аппаратом Гольджи и эндоплазм этическим ретикулумом клетки с образованием так называемых аутофагосом. Аутофагосомы атакуются первичными лизосомами, что приводит к образованию аутолизосом (или вторичных лиэосом). Набор лизосомальных катепсинов быстро гидролизует белки, поглощенные этими органоидами. Протенназы сока цитоплазмы дополняют действие катепсинов лиэосом.
Различные катепсины отличаются не только оптимумом рН, но специфичностью по отношению к белковым субстратам и пептидным связям, которые они гидролизуют. Все катепсины делятся на экзопептидазы, гидро- лизирующие крайние пептидные связи с N- или С-конца полипептидной цепи, и эндопептидазы, гидролизующие внутренние пептидные связи. В зависимости от особенностей каталитических групп активного центра различают тиоловые катепсины (в каталитическом центре содержится цнстен), аспарагиновые, или карбоксикатепсины (в каталитическом центре— аспарагиновая кислота), и сериновые (каталитический участок представлен серином).
Различные катепсины обозначаются латинсхими буквами. В настоящее время известны следующие катепсины млекопитающих.
Тиоловые протеииазы тканей. Катепсин В — оптимум рН 5, 5—6, 0. Он является эндопептидазой, но способен также отщеплять дипептиды с С-конца, т. е. действует как дипептидилдипептидаза. Гидролизует различные внутриклеточные белки (ферменты гликолиза, иммуноглобулины, миофибриллярные белки, коллаген, гемоглобин), а также способен превращать проинсулин в инсулин в поджелудочной железе. Найден во многих тканях организма.
Катепсин N, или коллагенолитический фермент, является эндопептидазой. Действует только на коллаген. Оптимум рН при действии на натив- ный коллаген 3, 6, а на растворимый 6, 0. Находится в лизосомах или в цитоплазме селезенки и плаценты человека. В других органах и тканях пока не найдеи.
Катепсин Н — эндопептидаза и аминопептидаза. В последнем случае отщепляет N-концевые аминокислоты от полипептидной цепи. Гидролизует многие растворимые белки цитоплазмы. Оптимум рН 6, 0—7, 0. Наиболее высокая активность его в печени человека.
Катепсин L — эндопептидаза. Обладает высокой способностью гидроли- зовать белки цитоплазмы с коротким периодом обновления. Оптимум рЙ 5, 0. Найден во всех тканях.
Катепсин С, или дипептидилдипептидаза I, является экзопептидазой. Отщепляет дипептид с N-конца полипептидной цепи. Связи, образованные пролином, не гидролизует. Оптимум рН 5, 0—6, 0. Особенность фермента состоит в том, что он проявляет полимеразную активность при рН 7, 0—8, 0.
Катепсин S — эндопептидаза. Оптимум рН 3, 0—4, 0. Находится в селезенке и лимфоузлах.,,
• Аспарагиновые протеиназы тканей. Катепсин D — эндопептидаза. Расщепляет пептидные связи, образованные ароматическими аминокислотами. Оптимум рН 3, 5—4, 0. Сходен по действию с пепсином. Катепсин считается примитивным представителем переваривающих ферментов одноклеточных организмов. Вероятно, в процессе эволюции его специализация привела к появлению пепсина. Содержится в лизосомах почти всех органов и тканей. Особенно активен в селезенке, почках, легких. Гидролизует многие белки цитоплазмы, миозин, основной белок миелина, гемоглобин. В хрящах действует на гидролиз протеогликанов, но при рН 5, 0.
Сериновые протеиназы тканей. Катепсин А, или карбоксипептидаза А, — зкзопептидаза, сходная по действию с панкреатической карбоксипептида- зой А. Отщепляет аминокислоты N-конца полипептидной цепи. Отмечается и слабая эндопептидазная активность (гидролизует связи, образованные карбоксильной группой тирозина). Оптимум рН 5, 0—5, 5. Схематически действие разных катепсннов на внутриклеточный гидролиз белков показано на рис. 56. В результате образуются свободные аминокислоты и дипептиды. Последние гидролизуются клеточными дипептидазами до аминокислот.
Биологическое значение катепсннов. Тканевый.гидролиз белков необходим для их обновления, устранения дефектных молекул белка, мобилизации эндогенного белка, с энергетическими целями (особенно при голодании). Следовательно, катепсины играют не только разрушительную, но и реконструктивную функцию. Недостаток катепсинов снижает возможности обновления белков тканей, что приводит к накоплению в них поврежденных, имеющих
слабую функциональную активность белков. Катепсины обладают способностью к ограниченному протео- л и з у, т. е. отщеплению какого-либо фрагмента полипептидной цепи. Эту функцию катепсинов можно считать ре- гуляторной — после такой обработки вновь синтезированные белки становятся активными (что явление похоже на обпа-
зование ферментов из пищеварительных проферментов). Ограниченный протеолиз в специализированных нейросекреторных клетках освобождает нейропептиды, выполняющие медиаторные и гормональные функции. По тому же механизму прогормоны, образующиеся в эндокринных железах, переходят в активные белковые гормоны.
2. Пути распада аминокислот до конечных продуктов
Пути распада аминокислот до конечных продуктов можно условно разделить на три группы: I) пути распада, связанные с превращением NH2-rpynn (каждая аминокислота имеет как минимум одну a-NH2-rpynny); 2) пути распада углеродных скелетов аминокислот; 3) декарбоксилирова- ние a-COOH-групп аминокислот. Третий путь является частным вариантом превращения углеродных скелетов аминокислот. Он используется при образовании биогенных аминов, поэтому излагается ниже при описании процессов образования и распада медиаторов.
Превращение a-аминогрупл аминокислот
|
В тканях организма происходит отщепление аминогрупп от аминокислот с образованием аммиака. Этот процесс называется дезаминированием. Возможны четыре типа дезаминирования: 1) восстановительное
R—СН—СООН -i^-R—СНг—СООН + NHS
2) гидролитическое
R—CH—СООН +н»°> R—СН—СООН + NH3
3) внутримолекулярное R—СНа-СН-СООН — R-CH-CH-COOH + NH3
4) окислительное
Общин продуктом всех типов дезаминирования является аммиак. Кроме аммиака образуются жирные кислоты, гидроксикислоты, ненасыщенные кислоты и кетокнслоты. Для большинства организмов, в том числе человека и животных, характерно окислительное дезаминироваяие, хотя для некоторых аминокислот, например гистидина, имеет место внутримолекулярное дезами- ннрование.
Окислительное дряяминиппняиие может быть двух видов — прямое и непрямое (трансдезаминнрование).
Прямое окислительное дезаминироваиие осуществляется оксидазамц L- и D-аминокислот, которые находятся в пероксисомах. Оксидаза L-аминокнс- лот содержит в качестве кофермента ФМН, а оксидаза D-аминокислот — ФАД. Реакция протекает по схеме
: н—СООН ------ у- r—С—СООН +н'° ■ r— С— СООН + NHj
r—СН—СООН ---- у- r—с—
L, л L
Продуктами реакции являются кетокислоты, аммиак и, Н202. Последний разлагается здесь же, в пероксисомах, каталазой до воды и кислорода. Оксидаза L-аминокислот малоактивна при физиологических значениях рН. Более активна оксидаза D-аминокислот. Однако ее значение до сих пор неясно, поскольку поступающие с пищей белки содержат L-аминокислоты. Возможно, часть L-амниокислот нзомеразамн бактерий кишечника превращается в D-аминокислоты, которые всасываются и дезаминируются в тканях оксида- зами D-аммнокяслог. Однако в целом прямое окислительное дезаминирова- ние играет незначительную роль в превращении NH2-rpynn аминокислот.
Трансдезаминированне — основной путь дезаминирования аминокислот. Оно происходит в два этапа. Первый — трансаминирование, т. е. перенос аминогруппы с любой аминокислоты на а-кетокислоту без промежуточного образования аммиака; второй — собственно окислительное дезаминироваиие аминокислоты. Поскольку в результате первого этапа аминогруппы «собираются» в составе глутаминовой кислоты, то второй этап связан с ее окислительным дезаминированием. Рассмотрим каждый нз этапов процесса трансдезами- нирования.
Траисмииироваине аминокислот было открыто советскими биохимиками А. Е. Браунштейном и М. Г. Крицман (1937). Оно может быть представлено следующей схемой:
R R' R R'
HC—NH3 + (Lo it < Lo + HC-NH, (iooH соон соон (iooH
Реакция трансаминирования обратима, она катализируется ферментами — аминотрансферазами, или трансаминазами. Аминотрансферазы имеются во всех животных и растительных клетках, а также в микроорганизмах. Уже обнаружено свыше 50 аминотрансфе раз. Большинство нз них действуют только на аминокислоты L-ряда; ко в микроорганизмах присутствуют аминотрансферазы, действующие только на О-аминоаделоты.
Источником аминогрупп в реакции трансаминирования служат не только природные а-аминокислоты, но и многие р-, у-, б- и е-аминокислоты, а также амиды аминокислот — глутамин и аспарагин.
Большинство известных аминотрансфераз проявляют групповую специфичность,. используя в качестве субстратов несколько аминокислот. Акцептором аминогрупп в реакциях трансаминирования являются три а-кетокис- лоты: пируват, оксалоацетат и 2-оксоглутарат. Наиболее часто акцептором NH2-rpynn служит 2-оксоглутарат; при этом из него образуется глутаминовая кислота. При переносе аминогрупп на пируват или оксалоацетат образуются соответственно аланин или аспарагиновая кислота по уравнению Исходная аминокислота + Пируват (нлн оксалоацетат) Кетоаннлог исходной аминокислоты +
-f Алании (или аспарагиновая кислота) Далее ЫН2-группы с вланина и аспарагиновой кислоты переносятся на 2-оксоглутарат. Эту реакцию катализируют высокоактивные аминотрансферазы: аланинаминотрансфераза (АЛТ) и аспартатаминотрансфераза (ACT), обладающие субстратной специфичностью:
| СООН | COOH | ||
| сн3 | < k | СИ, | in, |
| Н—С—NHj + | < k | -ML. < 1-0 + | d: H2 |
| СООН | < 1 = 0 | ['.ООН | H—(!; —NHj |
| dooH | C(X> H | ||
| ал" ННИ | '" 'ZSS! " | " - | |
| СООН | COOH | ||
| СООН | I | COOH | I |
| CH, | CH, | ||
| CHj | CH, | ||
| 1 + | CH, | + | CH2 |
| НС—NH. | C-0 | ||
| с-0 | 1 " | —С—NHj | |
| Соон | COOH | i | |
| COOH | COOH |
Аминотрансферазы состоят из апофермента и кофермента. Коферментзми аминотрансфераз являются производные пиридоксина (витамина В6) — пи- ридоксаль-5-фосфат (ПАЛФ) и пиридоксамин-5-фосфат (ПАМФ). Оба кофермента (см. строение их в гл. «Ферменты») обратимо переходят друг в друга в ходе реакции трансаминирования. Следует заметить, что аминотрансферазы для катализа требуют оба кофермента в отличие от других ферментов, которые нуждаются в одном из них н бывают либо пиридоксальфосфат- зависимыми, либо пиридоксаминфосфатзависимыми.
Механизм реакций ферментативного трансаминирования аминокислот был предложен советскими биохимиками (А. Е. Браунштейн и М. М. Шемякин) и зарубежными (Метцлер, Икава и Снелл). Согласно этому механизму NH2-rpynna аминокислот на первой стадии взаимодействует с альдегидной группой пирндоксальфосфата О—СН—ПАЛФ с образованием промежуточных шиффовых оснований типа альдимина и затем его таутомерной формы ке- тимина H3N—СН2—ПАМФ (шиффово основание пиридоксаминофосфата):
? 1 Н_*С—NHj + О = СН—ПАЛФ, -■ -> - Н—С—N =СН—ПАЛФ^г
R R
5-rC-N—СНа— ПАМФ: ^MfC-0 + H2N—СН5—ПАМФ dooH н'° Аоон
Далее кетимин гидролизуется с образованием кетоаналога исходной аминокислоты и ПАМФ. На второй стадии ПАМФ взаимодействует с а-кетокисло- той (акцептором аминогрупп) и все повторяется в обратном порядке, т. е. образуется сначала кетимин, затем альдимин. Последний гидролизуется. В результате образуются новая аминокислота и ПАЛФ. Таким образом, коферменты аминотрансфераз выполняют функцию переносчика аминогрупп путем" перехода из альдегидной формы в аминированную и обратно.
После уточнения механизма реакции, трансаминирования были получены доказательства, что в исходном состоянии альдегидная группа пирндоксальфосфата образует шиффово основание (альдимин) с «-аминогруппой лизинового остатка каталитического участка апофермента трансаминазы. Поэтому в ходе реакции аминогруппа субстрата, т. е. аминокислоты, замещает е-аминогруппу лизинового остатка апофермента с образованием комплекса ПАЛФ— субстратная аминокислота.
Окислительное дезаминироваиие глутаминовой кислоты. Биологический смысл реакций трансаминирования состоит в том, чтобы собрать аминогруппы всех распадающихся аминокислот в составе молекул всего одного типа аминокислоты, а именно глутаминовой. Глу- таминовая кислота поступает в митохондрии клеток, где протекает второй этап трансдеза минирования — собственно дезамннирование глутаминовой кислоты. Эта реакция катализируется глутаматдегидрогеназой, которая в качестве кофермента может использовать как НАД+, так и НАДФ+:
соон I
СН,
I 2
НС—NHj
| (НАДФ H+H^ I |
 J шепота < НАДФ+)
Рис. 57. Общая схема реакций трансдезаминирования (по А. Е. Браунштениу): / — трансэминкрование: // — дезаминироваиие
J шепота < НАДФ+)
Рис. 57. Общая схема реакций трансдезаминирования (по А. Е. Браунштениу): / — трансэминкрование: // — дезаминироваиие
|
< 1: оон
Схематически процесс трансдезаминирования показан на рис. 57. Обе стадии этого процесса обратимы. Обратная последовательность реакций, при которой происходит синтез аминокислот из а-кетокнслот и аммиака, был назван А. Е. Брауищтейном трансреаминированием. При трансреаминировании сначала происходит восстановительное амннирование 2-оксоглутарата с участием аммиака и восстановленного НАДФ. Процесс катализирует НАДФ-зависи- мая глутаматдегидрогеназа. При этом образуется глутаминовая кислота. Затем происходит перенос ЫН2-группы с глутамата на любую а-кетокислоту с образованием соответствующей аминокислоты. Если есть в тканях подходящие а-кетокислоты, то из них путем трансреаминирования могут синтезироваться аминокислоты. В животных тканях образуются а-кетокислоты заменимых аминокислот, а в растениях и бактериях — а-кетокислоты всех аминокислот.
Пути обезвреживания аммиака
Аммиак образуется в ходе следующих процессов:
1) дезаминирования аминокислот;
2) дезаминирования биогенных аминов (гистамина, серотонина, цисте- амина и т. д.);
3) дезаминирования пуриновых оснований (гуанина и аденина);
4) дезаминирования амидов аминокислот (аспарагина и глутамина);
5) распада пир им иди новых оснований (урацнла, тимина, цнтозина). Аммиак — очень токсичное соединение, особенно для нервных клеток.
При накоплении его возникает возбуждение нервной системы. Поэтому в тканях существуют механизмы его обезвреживания. К ним относятся: 1) образование мочевины; 2) восстановительное аминированне, или трансреамини- роВание; 3) образование амидов аминокислот — аспарагина и глутамина; 4) образование аммонийных солей.
Основной путь обезвреживания аммиака — синтез мочевины. Еще в прошлом веке русские ученые М. В. Ненцкий и С. С. Салаз- кин показали, что в печени происходит образование мочевины из аммиака и углекислоты. Кребс и Гензеклейт установили, что синтез мочевины представляет собой циклический процесс, в котором каталитическую роль играет ор-

|
нитин. Коген и Ратнер выяснили, что начальной реакцией этого цикла является синтез карбамоилфосфата. На рис. 58 приведен цикл образования мочевины. На образование одной молекулы мочевины расходуется три молекулы АТФ. Мочевина — безвредное для организма соединение. Главным местом ее образования в организме является печень, где есть все ферменты моче- вкиообразовання. В головном мозгу имеются все ферменты синтеза мочевины, кроме карбамоилфосфатсинтетазы, поэтому в нем мочевина не -образуется. Нарушение функции печени ведет к снижению мочевинообразовання, и содержание мочевины в крови и выделение ее с мочой падает.
Восстановительное аминнрование — малоэффективный процесс связывания аммиака, так как необходимы значительные количества 2-оксоглута- рата.
Образование асларагина н гяутамина является важным вспомогательным путем связывания аммиака. Оно протекает с участием аспарагинсин- тетазы и глутаминсинтетазы по уравнениям:
L-Аспартат + АТФ + NH3 ► L-AcnaparHH + АМФ + Н4Ра07
L-Г луг а мат ■ +■ АТФ + NH*—«-L-Глугамнн + ^Дф + наРО^ Этот процесс активен в нервной и мышечной тканях, в почках.
Образование аммонийных солей. Глутамин и в меньшей степени аспа- рагии считают своеобразной транспортной формой аммиака, так как, образуясь в тканях, они с кровью попадают в почки, где подвергаются гидролизу под действием специфических ферментов — глутаминазы и аспарагиназы:
L-Аспарагин + Н20»- Аспартат + NH3
L-Глугамнн + Н20 *-Глугамат + NHa
Освободившийся в канальцах почек аммиак нейтрализуется с образованием солей аммония
NH3 + Н+ + CI-»NH4C1
которые выделяются с мочой.
Превращение углеродных скелетов аминокислот Углеродные скелеты белковых аминокислот после отщепления аминогрупп превращаются в конечном счете в пять продуктов, которые вовлекаются в цикл Кребса. Глицин, аланин, лейцин, цистеин, серии, треонин, лизин, триптофан превращаются в ацетил-КоА; фенилаланин и тирозин — в аце- тил-КоА. и фумарат; изолейцин — в ацетил-КоА и сукцинил-КоА; валин, иетионин — в сукцинил-КоА; аргинин, гистидин, глутамин, глутаминовая кислота,, пролин — в 2-оксоглутарат; аспарагин и аспарагнновая кислота — в оксалоацетат. Сгорая до С02 и Н20, аминокислота дает значительное количество энергии, почти такое же, как при аэробном окислении глюкозы Интенсивный распад аминокислот, ведущий к образованию' ацетил-КоА, приводит к синтезу кетоновых тел в печени.
Поскольку в ходе распада углеводородных радикалов аминокислот образуются оксалоацетат и другие кислоты цикла Кребса, то это дает возможность использовать аминокислоты в печени и почках в глюконеогенезе.
3. Биосинтез заменимых аминокислот
В тканях млекопитающих возможен биосинтез только заменимых аминокислот, незаменимые должны поступать с пищей. Исходными веществами при биосинтезе заменимых аминокислот служат промежуточные продукты распада углеводов, метаболиты цикла Кребса и незаменимые аминокислоты.
|
|