
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Вторичная и третичная структуры РНК 4 страница
|
|
Участвуют в переносе в налам, в синтезе белка в рибосомах, который поступает затем в цистерны и каналы, в обезвреживании лекарств и ядов путем специальной ферментной системы. Окисление природных и чужеродных веществ происходит с
Продолжение табл. IS
|
М олекулярны е
| Часть II |
|
основы жизнедеятельности и патологии
А. ОБЩАЯ ХАРАКТЕРИСТИКА ОБМЕНА ВЕЩЕСТВ И ЭНЕРГИИ
ГЛАВА 9. ВВЕДЕНИЕ В ОБМЕН ВЕЩЕСТВ И ЭНЕРГИИ
Жизнедеятельность органцзд определяют особенности организации биож структур, обмена е и энергии, передачи генетической информаци н механизма регуляции. Повреждение любого из этих звеньев приводи' к раззитию патология* процесса и заболеванию. 3 молекулярных механизмов жизнедеятельности и их нарушений — основа для пс и применения в клинике препаратов биологической природы
1. Характеристика обмена веществ " В обмене веществ организма выделяют внешний обмен, который включает внеклеточное превращение веществ на путях их поступления и выделения, и промежуточный, происходящий в клетках. Под промежуточным обменом веществ, или метаболизмом, понимают совокупность всех химических реакций живой клетки.
Назначение метаболизма можно свести к следующим основным функциям: е I) аккумуляция энергии, извлекаемой при распаде химических веществ или улавливании света;
2) использование энергии для синтеза необходимых молекулярных компонентов (мономеров, макромолекул и т. д.) и совершения работы (осмотической, электрической, механической и др.);
3) распад обновляемых структурных компонентов клетки;
4) синтез и распад биологических молекул со специальным назначением (гормоны, медиаторы, гормоноиды, кофакторы и др.).
Цепи химических реакций образуют метаболические пути, или циклы, каждый из которых выполняет определенную функцию. Принято вы-
дел ять центральные и специальные метаболические пути. Центральные являются общими для распада и синтеза основных макромолекул. Они очень сходны у любых представителей живого мира. Специальные циклы характерны для синтеза и распада индивидуальных мономеров, макромолекул, кофакторов и т. д. Разнообразие их столь велико, особенно в растениях, что принято делить метаболизм растений на первичный и вторичный. К первому относят классические процессы синтеза и распада основных макромолекул (белков, углеводов, липидов, нуклеиновых кислот и т. д.), а ко второму, как бы производному от первого, относят превращение специальных биомолекул (например, алкалоидов, терпенов и т. д.), выполняющих регуляторные или иные функции, или просто являющихся побочными конечными продуктами обмена.
В обмене веществ принято выделять два противогк^южных процесса или ф-d.sbi: катаболизм и анаболизм. Катаболизм представляет собой расщепление крупных молекул на более мелкие. Анаболизм — это синтез сложных молекул из простых.
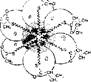
Катаболизм сопровождается освобождением энергии, которая может аккумулироваться в виде АТФ. При анаболических процессах происходит потребление АТФ с образованием АДФ и Н3Р04. Можно сказать, что АТФ является сопрягающим энергетическим звеном обоих путей метаболизма. Однако АТФ не единственный связующий компонент обоих путей. Кроме него при катаболизме макромолекул и мономеров образуются простейшие метаболиты, которые могут использоваться как исходный материал для биосинтеза мономеров и макромолекул, т. е в процессе анаболизма. Этот связующий путь, или цикл, объединяющий пути распада и синтеза веществ, называют амфиболическим (или двойственным). Значит, ката бол нчесхие и анаболические пути сопряжены не только через энергетическую систему АТФ—АДФ, но и через общие метаболиты, что придает гибкость и экономичность обмену веществ. -В случае надобности для биосинтеза используются простейшие промежуточные соединения и отпадает необходимость их поступления извне. Амфиболические пути связаны с терминальной, или окончательной, системой окисления веществ, где они сгорают до конечных продуктов (СОг и H2OJ с образованием большого количества энергии. Кроме них конечными продуктами метаболизма являются мочевина и мочевая кислота, образующиеся в специальных реакциях обмена аминокислот и нуклеотндов. Схематически план промежуточного метаболизма показан на рис. 18.
В ходе катаболнческих и анаболических процессов происходит обновление молекулярных компонентов клетки ЛСледует отметить самостоятельность путей катаболизма и анаболизма. Если бы эти пути совпадали и различались лишь направлением процесса, то в обмене возникли бы так называемые бесполезные, или футильные, циклы. Такие циклы имеют место при патологии, когда возможен бесполезный круговорот метаболитов. Чтобы этого не происходило, в клетках пути синтеза и распада веществ чаще всего пространственно разделены. Например, окисление жирных кислот происходит в митохондриях, а их синтез вне митохондрий — в микросомах.
2. энергетические циклы в жизои природе
Живые организмы используют разные источники питательных веществ и энергии. По источникам питания они делятся на две большие группы — автографы (самопитающиеся), использующие С02 в качестве исходного питательного
U6
материала для построения других углерод- содержащих веществ, и гетеротрофы (питающиеся за счет других), которые используют разнообразные органические соединения, синтезированные в других организмах (автотрофы как бы первичны по отношению к гетеротрофам). Автотрофы синтезируют из С02 восстановленные органические вещества (например, глюкозу), содержащие больший запас энергии, чем потребляемый углекислый газ.
По отношению к источникам энергии живые организмы делятся на фототрофы, для которых источником энергии служит солнечный свет, и хемотрофы, потребляющие энергию окислительно-восстановительных реакций. В окислительно-восстанови- тельных реакциях используется энергия донора электронов, которая извлекается клеткой при переходе электронов к химическому акцептору, т. е. к окислителю. Оба вещества в этих процессах всегда участвуют вместе и образуют пару донор—акцептор, или окислительно-восстановительную пару. Если такую пару составляют органические вещества, то живые организмы называются хемоорганотрофами, если неорганические, то хемолитотрофами. Разнообразие их дополняет отношение к кислороду как акцептору электронов Клетки организмов, потребляющих для этих целей кислород, относятся к аэробным, а не нуждающихся в нем — к анаэробным. Часто клетки высших организмов и бактерии имеют оба типа энергетики — анаэробный и аэробный. Поэтому такие клетки й организмы называют факультативными анаэробами, хотя степень факультативности, или зависимости от кислорода, у них различна. Например, " высшие организмы без него долго обходиться не могут- Имеются и облигатные анаэробы, в частности микроорганизмы, для которых кислород вообще не нужен и даже ядовит.
Зеленые растения обладают смешанным типом энергетики — фототроф- яым и хемоорганотрофным (дыхательным и гликолитическим), что позволяет им в разные периоды жизни потреблять энергию солнечного света, а при отсутствии его — энергию химических веществ. Особым разнообразием типов энергетики и их комбинаций отличаются микроорганизмы. В табл. 19 рассмотрены типы энергетики у представителей живого мира.
 Рнс. 18 Схема путей катаболизма и анаболизма Показана их связь через систему АТФ—АДФ- и амфнболический цикл метаболитов
Рнс. 18 Схема путей катаболизма и анаболизма Показана их связь через систему АТФ—АДФ- и амфнболический цикл метаболитов
|
Вследствие многообразия форм питания и потребления энергии живые организмы в природе тесно связаны Друг с другом. Взаимосвязь в питании и использовании источником энергии можно представить в виде своеобразных энергетических циклов живой природы. Главные партнеры этого цикла — Солнце как источник энергии, автофототрОфы, улавливающие солнечную энер-
Таблица 19 Гипы энергетики организмов
Донор — неоргаьнчсские вещества. t Донор и акцептор — неорганические
Донор — органические вещества;
Тор —смешанный (ор|ЗН! 'Ческие seL И °г)
иовительны? реакции
реакции органических в реакции неорганических
Хемоорганитрофиый
(аэробный)
Хемиорганотрофеый
Хемолнготрофный (аэробный) Хемоднтот р оф н ы й (анаэробный) ХемоярганотрофныЯ
(факультативно-анаэробный)
Фотохемотрофный
Фотох е чоор г а и отр о ф - Фоточемолитот рофньш
Фотосинтезируюшне ор
водоросли, бактерии Клетки яенвотных, бактерий, нефотосинтезиру- ющие клетки растений
Ф отоси нтез и ру ю щи е гки растений в раз фазы — световую у темновую
Фотосннтезирующие бэк
гию и синтезирующие из С02 углеводы и прочие органические вещества, и животные, потребляющие органические вещества и кислород, производимые фото- трофами. Потерн энергий, связанные с жизнедеятельностью всех организмов на Земле; возмещаются энергией солнечных лучей. Следует отметить, что клетки животных и человека используют в качестве энергетического материала сильно восстановленные вещества (углеводы, липиды, белки и др.), т. е. содержащие водород. Водород — энергетически ценное вещество. Его энергия переходит в энергию химических связей АТФ в гетеротрофных организмах.
3. Энергетика биохимических реакций
Чтобы понять сущность процессов обмена веществ и энергии, нужно познакомиться с некоторыми общими положениями энергетики.
Все химические реакции жнвой клетки, из которых складывается обмен веществ, подчиняются законам энергетики. Первый закон утверждает, что энергия химических реакцвй не исчезает и не возникает из ничего, она лишь может переходить нз одной формы в другую. Знание этого закона позволяет описать энергетический баланс химического процесса.
Самопроизвольно химические процессы могут протекать лишь в одном направлении — в направлении состояния равновесия, по мере достижения которого они прекращаются. Предсказать направление биохимических процессов позволяет второй закон термодинамики (энергетики), согласно которому все самопроизвольные процессы протекают в направлении, соответствующем максимальной при данных условиях энтропии, до тех пор, пока не установится равновесие реакции. Энтропия — мера разупорядочеииости системы. Увеличение энтропии, проявившееся в ходе реакции, препятствует возврату к исходному состоянию, ибо для этого потребовалось бы вновь уменьшить энтропию химической системы. Самопроизвольно разупорядоченная система никогда не превращается в упорядоченную. Поэтому все реакции, которые сопровождаются возрастанием энтропии, необратимы Для обращения их необходимо затратить дополнительную энер|ию, которая позволила бы компенсировать затраты на изменение энтропии и перевести систему из неупорядоченного состояния в упорядоченное.
Однако практически проще всего предсказать направление химических реакций с помощью так называемой свободной энергии, которую в отличие от энтропии можно измерить в ходе реакции. Свободная энергия — это та часть энер1ин системы, которую можно использовать для совершения работы при постоянных температуре и давлении. Ее обозначают символом AG. Та часть энергии химического процесса, которая не может быть превращена в работу при постоянных давлении и температуре, называется связанной энергией и выражается произведением TAS, где Т — абсолютная температура; AS — изменение энтропии системы при данном химическом превращении. Сумма изменений свободной и связанной энергий называется энтальпией (внутренней энергией системы) или теплосодержанием системы и обозначается АН. Энтальпия измеряется опытным путем и равна количеству теплоты, выделяющейся в данном процессе. Изменение ее описывается уравнением
AH—AG + TbS. Отсюда
АС^АН — TAS.
Энергетическое состояние любой системы, в том числе клетки и организма, можно выразить, используя это очень важное уравнение. Выражают свободную энергию в килоджоулях на моль вещества (кДж/моль).
Свободная энергия очень удобна для определения самопроизвольности или несамопроизвольности химического процесса. При самопроизвольных процессах происходит уменьшение свободной энергии, т. е. AG имеет отрицательное значение. Такие реакции называют экзергоническими, т. е.'протекающими с освобождением энергии. Эти реакции поставляют клетке энергию. Процессы, идущие с увеличением свободной энергии (т. е. AG имеет положительное значение), не могут протекать самопроизвольно. Они требуют притока энергии извне. Такие процессы называют эндергонинескими, т. е. идущими с потреблением энергии. В состоянии равновесия AG =0.
Свободная энергия химических реакций оценивается в стандартных условиях и в реальных, или физиологических, условиях. Под стандартной свободной энергией AG° биохимических реакций понимается измерение ее в стандартных условиях: при концентрации компонентов реакции 1моль/л, температуре 25°С (298ЧК) и рН 7.
Ьсли исходным веществом или продуктом реакции явлиеи.я вода, то ее концентрацию тоже принимают равной 1, 0 моль/л, хотя истинная концентрация воды в разбавленных растворах близка к 55 моль/л.
Стандартную свободную энергию находят по разности между суммарными
значениями свободной энергии конечных продуктов и исходных веществ. Величина бф для биохимической реакции, идущей в физиологических условиях, рассчитывается с учетом фактической концентрации компонентов.
Используя свободную энергию для характеристики обмена веществ, можно сказать, что катаболические реакции идут с освобождением энергии, а анаболические — с потреблением. Анаболические могут протекать только в сопряжении с первыми. Роль энергетических посредников между ними выполняют высокоэнергетические, или макроэргические, вещества.
4. Понятие о высокоэнергетических и
Принято делить все соединения на высокоэнергетические и низкоэнергетические. Условной границей для двух групп соединений является значение свободной энергии гидролиза фосфатной связи около 20 кДж/моль. Не следует путать эту величину, которая используется для характеристики биохимических процессов, с энергией связи, под которой понимается энергия, необходимая для разрыва связи между двумя атомами.в любой молекуле. При разрыве же фосфатной связи наряду с освобождением энергии происходит образование неорганических фосфатов.
В табл. 20 приведены, энергетические характеристики некоторых веществ.
Таблица 20. Стандартная свободная энергия гидролиза (ДС°) некоторых высокознергетиче- ских и ниэкознергетических соединений и свободная энергия гидролиза соединений при физиологических концентрациях
Соединение —Дй°, кДк'/моль I — Д0Ф. кДж/моль
Фосфоенол пиру ват 1, 3-Дифосфоглнцерат Креат ии фосфат АТФ
Аиетил КоА АДФ
Пирофосфат (Н, Р207) УДФ-мюкоэа Глюк озо-1 - фосфат
Высокоэнергетические
61.7
49.2 42, 5 30, 4 30, 4
28.3 28, 3 24.2
| 41, 7 50, 0 |
| Низкоэнергетические 15, 8 |
| Фру кто jo-6-фосфат АМФ Гл юк оз о - 6-фосф ат а-Глнцерол фосфат |
Обращает на себя внимание, что АТФ — ключевой энергетический посредник в обмене веществ — не является веществом, наиболее «богатым» энергией. АТФ находится в середине энергетической шкалы.
Возможно несколько вариантов освобождения энергии фосфатных связей АТФ:
(2) (1)
Н, Р207 н—|- АТФ----- ■ < -АДФ 1 Высокоэнергетические
(пнрофосфят) III соединения
JO, | ||Ч
2НаР04 АМФ Н3РОч АМФ HjP04 Низкоэнергетические
соединения
Наиболее частый вариант — это отщепление концевого фосфата АТФ:
АТФ АДФ 4- НзРО, (I)
Концевой фосфат соединяется с водой или переносится на другое вещество, которое при этом фосфорилируется. Другой пример освобождения энергии фосфатной связи — пирофосфатное расщепление АТФ:
АТФ.-АМФ + Н^О, (2)
Этот тип реакции реже используется в биологических процессах. Особенностью его является образование пнрофосфата, который относится к «богатым» энергией веществам. При гидролизе пирофосфата (3) освобождается примерно столько же энергии, сколько при гидролизе концевых фосфатных связей АТФ. В биологических процессах богатые энергией связи пирофосфата мало используются для синтеза других веществ, так как при его гидролизе освобождается тепловая энергия.
Возможно использование АДФ как высокоэнергетического соединения в биохимических процессах. При отщеплении концевой фосфатной связи АДФ (4) высвобождается то же количество энергии, что и при' отщеплении концевой фосфатной связи АТФ. На первый взгляд АДФ может заменять в аналогичных реакциях АТФ, в частности при фосфорилнровании других веществ. Однако эта возможность не реализуется в биологических процессах. По крайней мере, пока такие реакции неизвестны. Известно, что возможен гидролиз -АДФ до ннзкоэнергетических АМФ и фосфата с выделением теплоты.
Долгое время существовали трудности при определении свободной энергии фосфатной связи АТФ. Стандартная свободная энергия гидролиза (ДО0) фосфатной связи АТФ равна примерно — 30, 4 кДж/моль. Стандартные условия: I М концентрации исходных веществ и конечных продуктов, рН 7, 0, температура 37°С и избыток ионов магния. При физиологических условиях в клетке, кбнечно, не имеется таких высоких концентраций исходных веществ и продуктов, ионов Mg2+; возможны отклонения и в значениях рН. Поэтому реальная свободная энергия гидролиза концевой фосфатной связи АТФ, АДФ и фосфатных связей пирофосфата приближается к —50, 0 кДж/моль (табл. 20). Обращает внимание то, что Aи для других соединений отличается от стандартной, но не обязательно в сторону больших значений.
5. Перенос энергии в биохимических процессах
В процессе жизнедеятельности происходит непрерывное перераспределение энергии химических веществ, поступающих в клетку. Накопление энергии в специфических фосфатных связях АТФ лежит в основе механизма переноса энергии в живой клетке. Живая клетка — неравновесная химическая система, в результате чего и возможно накопление химической энергии в фосфатных связях АТФ за счет освобождения ее в ходе расщепления питательных веществ.
В клетке имеют место три основных типа перехода энергии АТФ: в энергию химических связей, в тепловую энергию и энергию, затрачиваемую на совершение работы. Рассмотрим в общем виде перенос энергии химических связей. Химическая реакция
сопряжена с образованием энергии АТФ. Если реакция будет находиться в состоянии равновесия, то перенос энергии совершается со 100%-ной эффективностью. Однако накопления АТФ не произойдет, так как в состоянии равновесия количество высвобождаемой свободной энергии равно нулю. Значит, для накопления энергии в фосфатных связях АТФ нужно, чтобы реакция была неравновесной. Это достигается тем, что часть энергии химической реакции теряется в виде теплоты. При этом оставшаяся часть энергии вещества переходит в энергию фосфатных связей АТФ. Следовательно, биологические генераторы энергии не могут иметь коэффициент полезного действия, равный 100%.
Третий путь перехода энергии — в работу. Энергия химических связей АТФ может затрачиваться на осмотическую, электрическую, механическою и другие виды работы. При этом не вся энергия АТФ используется на совершение работы. Часть ее рассеивается в виде теплоты. Особенно много теплоты выделяется при сокращении мышц. Это механохимический механизм образования теплоты в живых организмах. Теплота бесполезна для совершения работы живых систем. Лишь у теплокровных она используется для согревания и поддержания постоянной температуры тела, равной примерно 37°С.
Все химические процессы в организме могут протекать только с участием ферментов. Поэтому прежде чем рассматривать механизм извлечения энергии в отдельные пути обмена веществ, обратимся к ферментам.
ГЛАВА 10. ФЕРМЕНТЫ
1. Введение в науку о ферментах
Ферменты — биологические катализаторы белковой природы. Термин «фермент» (от лат. fermentum — закваска) был предложен в начале XVII в. голландским ученым Ван Гельмонтом для веществ, влияющих на спиртовое брожение. Спиртовое брожение представляет собой химический процесс, а в дрожжах или их экстрактах, употреблявшихся в качестве закваски для ускорения брожения, присутствуют природные катализаторы, являющиеся, как оказалось впоследствии, белками (есть данные, что ферментными свойствами, возможно, обладают и нуклеиновые кислоты). Поэтому за биологическими катализаторами, ускоряющими не только брожение, но и любые химические реакции в живом организме, сохранился термин «фермент». В литературе встречается синоним этого термина энзим. Ферменты свойственны только живой природе, которая использует их в качестве своеобразного инструмента обмена веществ. Ни один химический процесс не может протекать в живых организмах без ферментов.
Основные вехи в изучении ферментов. Первые упоминания о ферментах как о неких веществах, влияющих на спиртовое брожение, появились в начале XVII в. в работах немецкого ученого Либавия и голландского Ван Гельмонта. В конце XVIII в. работы Реомюра и Спалланцани о растворяющем влиянии желудочного сока хищных птиц на мясо показали, что растворение мяса есть химический, а не механический процесс. В 1836 г. Шванн обнаружил в желудочном соке фермент пенсии, переваривающий белки мяса. Русский ученый К. С. Кирхгофф впервые показал участие химических вешеств (ферментов) солода в превращении крахмала в сахар. Позднее, в 1837 г., Пайеи и Персо выделили это активное начало из экстракта 'солода в виде порошка и доказали его термолабильность. В 1837 г. Берцелиус сравнил ферменты с неорганическими катализаторами. Позднее серией работ, выполненных в разные годы русским ученым М. М. Манассеиной и немецкими учеными братьями Г.' Бухнером и Э. Бухнером, была доказана несостоятельность деления ферментов на организованные и неорганизованные, т. е. на ферменты и энзимы. После их работ термины «фермент» и «энзим» стали синонимами. В 1894 г. Э. Фншер предложил гипотезу, объясняющую специфичность ферментов и получившую название гипотезы «ключа и замка».
В начале XX в. выдающийся русский физиолог И. П. Павлов, работая с ферментами пищеварения, впервые доказал, что ферменты могут существовать в живом организме в неактивной форме — в виде проферментов. Он показал превращение профермента трипеиногена в активный фермент трипсин с помощью энтерокиназы. И. П. Павлов предложил новые' методы определения активности ферментов. Михаэлис и Ментен (1913) разработали теорию механизма действия-ферментов и кинетику ферментативных реакций. В 1926 г. Самнер впервые получил фермент (уреазу) в кристаллическом виде и установил его белковую природу. Внланд и Пфлейдерер (1957) доказали существование ферментов в виде молекулярных форм — изоферментов. Филлипс (1960) впервые расшифровал трехмерную структуру фермента ли- зошша с помощью рентгеноструктурного анализа.
На современном этапе ферментология (энзимология) — важнейшая и стремительно развивающаяся область биохимии, достижения которой широко используются в практнческоймедицине, фармации, пищевой промышленности и других отраслях народного хозяйства.
Общие представления о катализе. Вероятность протекания химической реакции определяется разницей между свободной энергией исходных веществ и продуктов реакции. Если свободная энергия выше у исходных веществ, чем у продуктов (т. е. AG отрицательна), то возможно самопроизвольное течение реакции (реакция зкзергоническая). Обратное соотношение в показателях свободной энергии говорит об энергетической невозможности реакции (реакция эндергоническая). Однако энергетическая возможность протекания экзер- тонической реакции абсолютно ничего не говорит о том, какова будет скорость этой реакции. Например, реакция сгорания бензина в присутствии кислорода является резко экзергонической, но при обычной температуре окисление углеводородов бензина кислородом идет настолько медленно, что его трудно зарегистрировать. Достаточно же небольшого нагревания, т. е. какого-то
дополнительного количества энергии, как бензин воспламеняется и реакция сгорания (превращения реагентов в продукты) протекает самопроизвольно с большой скоростью.
Скорость экзергониче- ской реакции зависит от энергетического барьера, который необходимо преодолеть реагирующим веществам, причем высота этого
Рис 19 Дииграима изменения энергии реакции без фер- барьера неодинакова для чентс! (сплошная линия) и с ферментом Е'а (пунктирная разных реакций.
Кинетическая энергия реакционноспособных моле-
Кул достаточна для преодоления этого барьера. Для характеристики скорости химических реакций Аррениус ввел понятие об энергии активации, или свободной энергии активации. Свободной энергией активации называется дополнительное количество энергии (например, нагревание в приведенном выше случае с горением бензина), которое необходимо сообщить молекулам вещества, чтобы они преодолели энергетический барьер реакции, т. е. вступили в реакцию. В обычных условиях лишь небольшая доля молекул обладает необходимой кинетической энергией, способной преодолеть энергетический барьер.
Диаграмму изменения свободной энергии в холе химической реакции можно представить в виде графика, изображенного на рис. 19. Чем выше энергия активации, тем выше барьер и тем медленнее протекает реакция.
Фермент (или катализатор) не влияет на изменение свободной энергии исходных веществ и продуктов реакции, т. е. энергетическая возможность реакции, определяемая AG, не зависит от фермента. Фермент понижает энергию активации реакции Е„ т. е. снижает высоту барьера, в результате возрастает доля реакционноспособных молекул, а значит, увеличивается и скорость реакции. Чем больше снижается.энергия активации, тем эффективнее действует катализатор и тем больше ускоряется реакция. Каждый фермент, как н любой катализатор, имеет свой предел ускорения реакции.
Сходство и различие между ферментами и неферментиыми катализаторами. Ферменты и небиологические катализаторы, подчиняясь общим законам катализа, имеют следующие сходные признаки.
1. Они катализируют только энергетически зозмсжные реакции
2 Они никогда не изменяют направления реакции.
3. Они не изменяют равновесия обратимой реакции, а лишь ускоряют его наступление
4. Они не расходуются в пооцессе реакции. Поэтому фермент в клетке работает до тех пор, пока по каким-либо причинам не рачпушится

|
Однако ферменты обладают и особыми качествами, отличающими их от небиологических катализаторов. Эти отличия связаны с особенностями строения ферментов, являющихся сложными белковыми молекулами.
1. Скорость ферментативного катализа на& ного выше, чем небиологического. Из этого следует, что ферменты сйльнее снижают энергию активации реакции, чем небиологические катализаторы. Например, энергия активации реакции разложения пероксида водорода
НА —Н20 |/го2
равна 75, 3 кДж/моль, и самопроизвольное разложение Н202 протекает настолько медленно, что кислород, выделяющийся в виде пузырьков, визуально не заметен. При добавлении неорганического катализатора — железа или платины — => нрпгтия яктивяции снижается до 54J кДж/молк пеякпия ускоряется в тысячи раз и становится заметной по выделению пузырьков кислорода. Фермент каталаза, разлагающий Н202, снижает " энергию активации более чем в 4 раза (до 80 кДж/моль) и ускоряет реакцию разложения пероксида в миллиард раз. Реакция протекает настолько бурно, что раствор от выделяю шнхся пузырьков кислорода буквально «закипает».
|
|