
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Вторичная и третичная структуры РНК 3 страница
|
|
Гемпротеиды
По биохимическим функциям гемпротеиды делятся на неферментные (гемоглобин, миоглобин и др.) и ферментные (цитохромы, каталаза, пероксидаза и др.). Небелковая часть гемпротеидов — гем является металлопорфириновым комплексом. Порфирин имеет много изомеров в зависимости от положения заместителей в макроцикле. Один из его изомеров - протопорфирин IX — имеет в положениях 1, 3, 5, 8 метильные группы, в положениях 2 и 4 — ви- нильные и в положениях 6 и 7 — пропионнльные:

|
| н3< |
| нз( |
| CHJCHJCOOH HOOCHjCHJC |
| протопорфирнн IX |
| пи IX |
| : н=сн2 |
| ноосн2сн2с |
| сн2сн2соон |
Комплекс пр отопорф ирина IX с Fe2+" называется протогем или просто гем, а с Fe3+ — геман. Координационное число для железа равно шести. В теме железо связано двумя ковалентными связями с атомами азота двух пиррольных колец и двумя координационными связями с атомами азота остальных пиррольных колец. Из двух неиспользованных координационных связей одна идет на соединение с белком, а вторая — на соединение с различными лигандамн (физиологическими — кислород, вода и чужеродными — диоксид углерода, цианид и т. д.)..
Кроме наиболее распространенного гема' IX имеются и другие разновидности гемов: гем а, имеющий формильную группу в положении 8, гидрокси- алкильную в положении 2 и алкилвинильную в положении 4; гем с, в котором- с винильными группами в положениях 2 и 4 связаны остатки цистеина. Гем d представляет собой железодигндропорфирин. Один из вариантов гема входит в разные гемпротеиды, которым он придает красную окраску,
Рассмотрим строение и функции отдельных представителей гемпротендов.
Гемоглобин. Гемоглобин имеет четвертичную структуру. Молекулярная масса его 66 ООО—68 ООО. Как следует из названия, гемоглобин представляет собой соединение гема с белком глобином. Глобин имеет четыре субъединицы, или полипептидные цепи. Каждая из пол-ипептидных цепей, или субъединиц, обозначается буквами. У гемоглобина взрослого человека (НЬА) эти цепи называются альфа (а) и бета (р). Каждая молекула НЬА содержит по две а- и (I-цепи. Они различаются первичной структурой и длиной' полипептидной цепи: а-цепи содержат по 141 аминокислотному остатку, {5-цепи — по 146. Вторичные структуры их представлены в виде спиральных сегментов различной длины, соединенных неспиральными участками. В а-цепях семь спиральных сегментов; в jJ-цепях восемь. Спиральные сегменты обозначаются латинскими буквами (А, В, С, D, E,.F, G, Н). Третичные структуры а- и р? цепей очень сходны. Внутри каждой субъединицы имеется гидрофобный «карман», в котором располагается гем. Гем прочно удерживается в этом «кармане» благодаря ван-дер-ваальсовым связям между неполярными участками гема и гидрофобными радикалами аминокислот (этих связей около 60). Остатки пропионовой кислоты гема образуют одну-дзе дополнительные ионные связи с белком. Однако глобин связан не только с порфириновым кольцом гема, но и с атомом железа. Железо связывается с имидазольным радикалом гистидина. Это пятая координационная связь Fe с азотом бокового радикала гистидина (четыре связи Fe затрачиваются на
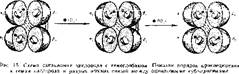
Рис. 14 Схема связи тема с глобином (а) в молекуле гемоглобина и расположение субъединни
а четвертичной структуре (6) гемоглобина. Субъеликииы условно изображены а виде полусфер, а гем — а виде дисков Сплошными линиями показаны
соединение с пиррольными кольцами протопорфирина IX). Шестая координационная связь Fe свободна и используется для связывания кислорода или других лнгандов (рис. 14).
Белковая часть молекулы гемоглобина влияет на свойства гема и наоборот. 6 частности, пространственное расположение валнна в гемовом кармане а- и Р-цепей глобина неодинаково. В Р-цепях он занимает положение молекулы кислорода. Поэтому присоединение кислорода к гему начинается с а-цепей
Четвертичная структура гемоглобина похожа на тетраэдр. Субъединицы располагаются попарно (см. рис. 14).
Между разнородными субъединнцами, т. е. между а: -субъединицей, с одной стороны, и Pp. Рг'Субъединнцами — с другой очень много ван-дер-ваальсо- вых связей. Такие же связи удерживают вместе а2- и -субъединицы. Связи между субъединицамн одного типа имеют ионный или солевой характер. Но число их непостоянно и зависит от числа присоединившихся к гему молекул кислорода. В бескислородном гемоглобине (он называется дезокснгемоглобин) имеется четыре ионные связи: две а, —а2 и две |3, —02 (см. рис. 14).
Функция гемоглобина. Основная функция гемоглобина состоит в связывании кислорода и переносе его от легких к тканям. В каждом эритроците около 400 млн. молекул гемоглобина, каждая из которых способна связать четыре молекулы 02, т. е. по одной на субъединицу. Гемоглобин, связанный с кислородом, называется оксигемоглобин.
Рассмотрим дыхательный цикл «молекулярного легкого», как назвал гемоглобин известный английский ученый М. Перутц, установивший его пространственную структуру.
В дезоксигемоглобине у атома железа одна связь вакантна. Она-то и «ловит» молекулу кислорода. В оксигемоглобине атом железа помещается в плоскости порфирннового кольца, а в дезоксигемоглобине он имеет большие размеры {так как изменяется спиновое состояние атома железа) и выступает из плоскости гюрфиркновсго кольца. Нужно отметить, что в оксигемоглобине железо остается двухвалентным.
В молекуле гемоглобина четыре гема работают согласованно. Такое поведение гемов называется кооперативным. В дезоксигемоглобине атомы железа, 104
|
связав кислород, втягиваются в плоскость порфирииового кольца- Труднее всего присоединяется первая молекула кислорода, а каждая последующая все легче. Например, последняя (четвертая) молекула кислорода связывается в 500 раз быстрее, чем первая. На рис. 15 показана последовательность присоединения 02 к субъединицам гемоглобина, Первая молекула 02 соединяется с гемом а, -субъединицы. При этом две ионные связи а, —а2 рвутся. Субъединицы становятся более подвижными, что облегчает присоединение второй молекулы кислорода к гему а2-субъединицы. Оставшиеся две а, —а2 ионные связи также разрываются, что дает возможность остальным гемам принять выгодное положение для присоединения кислорода. Третья молекула 02 соединяется с Pj-субъединицей. Одна из ионных р, —р2-связей разрывается, облегчая доступ кислороду к последнему атому железа гема р2-субъединицы. При этом разрывается последняя ионная связь р, —р2. Загруженный кислородом гемоглобин отдает его сначала с трудом, а затем все легче и легче. Такое кооперативное поведение гемов имеет физиологическое значение.
Оксигемоглобин освобождается от кислорода на 80% всего при четырехкратном перепаде парциального давления кислорода (от ГО, 6 до 2, 6 кПа, или от 80 до 20 мм рт. ст.). Если бы гемы действовали автономно, то такая разгрузка потребовала бы 90-кратного перепада давления. Так как это невозможно, 'то основная часть кислорода не могла бы оторваться от гемоглобина и использоваться тканями. Человек задохнулся бы даже в атмосфере чистого кислорода.
Производные гемоглобина. Молекула гемоглобина взаимодействует с различными лигандами. На рис, 16 показано образование производных гемоглобина. Очень высоко сродство гемоглобина к оксиду углерода (11) СО — примерно в 300 раз выше, чем к кислороду. Это говорит о высокой токсичности угарного газа, который выводит из строя гемоглобин, не давая ему участвовать в переносе кислорода. В карбоксигемоглобине железо двухвалентно. При дей-
карбоксигемотлобин
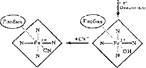
|
| дезохсигем оглобнн |
| окгигвмоглобин |
| циакметгемоглобин |
| метгемоглобии |
Рис. 16 Схема образования производных гемоглобина
ствии окислителей (например, нитрита натрия) образуется метгемоглобии, в котором железо трехвалентно, он не способен связывать кислород. Появление метгемоглобии а в больших количествах вызывает кислородное голодание тканей, Однако метгемоглобии обнаруживает н другие свойства. Он легко связывает CN- с образованием цианметгемоглобина и спасает организм от смертельного действия цианидов. Поэтому для лечения отравлений цианидами применяют метгемоглобинобразователи (тот же нитрит натрия).
Возможно образование еше одного производного гемоглобина — карбге- моглобина, когда гемоглобин связывается с С02. Однако С02 присоединяется не к гему, а к NHj-группам глобина: HbNH2 + С02HbNHCOO" + Н+. Причем дезоксигемоглобин связывает больше С02, чем оксигемоглобин. Образование карбгемоглобина используется для выведения С02 из тканей к легким Этим путем выводится 10—15% С02.
Типы гемоглобина. Гемоглобины могут различаться по белковой части. Различают физиологические и аномальные типы гемоглобинов. Физиологические образуются ка разных этапах нормального развития организма, а аномальные — вследствие нарушений последовательности аминокислот в глобине физиологических типов гемоглобина.
| лобкн ПЬГ |
| •ем |
Физиологические типы гемоглобина отличаются друг от друга набором полипептидных цепей, или субъединиц, образующихся на разных этапах развития организма человека — от эмбрионального до взрослого состояния. различают следующие физиологические типы гемоглобинов: примитивный ■ •ечоглобин НЬР (к нему относятся гемоглобины, называемые Ровер 1 и Говер 2).
лод), гемоглобин взрос.
НЬА;, НЬА3 (от лат. aduitus — взрослый).
НЬР появляется на самых ранних стадиях развития эмбриона. В первые недели развития, когда в'желточном мешке возникают очаги кроветворения, начина
ется синтез первых цепей глобина, которые называются е-цеп и. Первый гемоглобин формируется из четырех е-цепей. Он называется Говер I. Затем у эмбриона, длина которого не превышает 2, 5 см, начинается синтез а-цепей. Поэтому образуется более зрелый тип примитивного гемоглобина Говер 2, который состоит из двух е- и двух а-цепей. Эти гемоглобины полностью исчезают примерно у трехмесячного эмбриона. Если они остаются у новорожденного, то это признак врожденных аномалий развития. Примитивные гемоглобины заменяются на HbF, так как вместо е-цепей синтезируются у-цепи. HbF состоит из двух а- и двух уцепей. HbF является главным типом гемоглобина плода и составляет к моменту рождения примерно 70% всего гемоглобина. На поздних стадиях развития плода появляется гемоглобин взрослых НЬА и НЬА2. НЬА состоит из двух а- и двух р-цепей, НЬА2 — из двух а- и двух 6-цепей.
В течение трех-четырех месяцев после рождения происходит резкое снижение HbF до 1—2% и замена его на НЬА. В крови взрослого человека примерно 95—96% НЬА, 2—3% НЬА2 и 0, 1—2% HbF. Гемоглобины НЬА2 и HbF обладают большим сродством к кислороду, чем НЬА. При старении эритроцитов появляется в небольших количествах НЬА3, у которого имеются изменения в строении Р-цепей. Состав цепей у него тот же, что и у НЬА.
Аномальных типов гемоглобина обнаружено свыше CTd Они различаются или составом цепей, или, чаще, заменой аминокислот в цепях, например, существуют аномальные гемоглобины, содержащие четыре р-иепи — HbH или четыре 7-цепн — НЬ Барта. Из аномальных гемоглобчнов часто ветре чается HbS, или серповидноклеточный гемоглобин. Он обнаруживается у больных серпоБИдноклеточной анемией и называется так потому, что эритроциты, содержащие HbS, принимают форму серпа. У этого гемоглобина в (5-цепи глута миновая кислота заменена на валин.
Миоглобин имеет третичную структуру и представляет собой одну цепь гемоглобина. В отличие от гемоглобина он в пять раз быстрее связывает кислород. Кривая насыщения его кислородом имеет вид гиперболы. В этом кроется большой биологический смысл, поскольку миоглобин находится в глубине мышечной ткани (где низкое парциальное давление кислорода). Жадно связывая кислород, миоглобин создает кислородный резерв, который расходуется по мере необходимости, восполняя временную нехватку кислорода.
Мономерные гемоглобины больше похожи по свойствам на миоглобин, так как имеют одну полипептидную цепь, связанную с гемом. Например, 'легге- моглобин, найденный в корневых клубеньках бобовых растений. Очевидно, функция его состоит в накоплении кислорода, а не в переносе его.
Ферментные гемпротеиды. Цитохромы делятся на несколько типов в зависимости от гема, входящего в их молекулу. Различают цитохромы а, Ь, с, d. Цитохромы а, b и с в качестве простетической группы содержат соответственно гемы a, b и с и различаются между собой аминокислотным составом полипептидной цепи и числом белковых субъединиц. Цитохромы d иногда кроме гема d содержат и гем с.
Цитохромы не способны связывать кислород, за исключением цитохрома а3, в который входит нон меди, связанный с глобином Цитохромы переносят- электроны и входят в состав дыхательной цепи митохондрий и цепи микросом
Каталаза и пероксидаза имеют тот же гем, что и гемоглобин. Они участвуют в разложении пероксида водорода. Поскольку гем у этих ферментов и гемо глобина одинаков, а возможно и укладка его в белковом кармане ферментов сходна с укладкой в гемоглобине, то неудивительно, что гемоглобин также обладает свойствами каталазы и пероксидазы разлагать пероксид водорода.
Хлороф и л л протеиды
В отличие от железопорфиринов животных в растениях содержатся магнийпор- фириновые комплексы, придающие листьям зеленую окраску. Эти пигментные комплексы называются хлорофиллами. В листьях растений имеются две разновидности — а и Ь, в водорослях — еще с и if, В некоторых бактериях выделен хлорофилл, сходный с хлорофиллом высших растений и водорослей и названный бактериохлорофиллом. Порфириновое ядро хлорофилла (без магния) называется феофитином. Оно содержит аигилропорфирин и остаток спирта фитола. В растениях хлорофиллы образуют комплекс с белками и участвуют в фотохимических реакциях.
5. Металлопротеиды
Металлопротенды составляют обширную группу смешанных макромолекул. Среди них имеются как ферментные, так и неферментные металлопротеиды Ьапример, в составе металлоферментов — дипептидазы и алькогольдегидро- геназы — имеется цинк, а в такой неферментный металлопротеид, как транс- феррнн, выполняющий транспортную функцию, входит железо.
Некоторые металлопротеиды выполняют функции гемоглобина, например гемоцианин, гемэритрин, гемованадин. Гемоцианин (от греч. haima — кровь и kyanos — лазурный) придает голубой оттенок крови. Встречается у моллюсков. Акцептором кислорода у него является ион меди, соединенный непосредственно с большим числом субъеднниц белковой части. Каждые два иона меди соединяются с одной молекулой 02.
Гемэритрин — типичный железопротеид; он обнаружен у червей. Состоит из 8 субъединиц белка, соединенных с железом. Два атома железа гемэритрина связывают одну молекулу кислорода.
Выделен еще один металлопротеид, акцептирующий кислород, — гемованадин. Он имеет одну субъединицу. В качестве связывающей группы у негб выступает ион ванадия. Каждый атом ванадия присоединяет мрлекулу 02
6. Небелковые смешанные макромолекулы Углевод-липидные комплексы. Смешанные макромолекулы углевод-липидных комплексов состоят из углеводного и липидного компонентов. В зависимости от доли каждого из них различают гликолипиды и липополисахариды. В глико липидах (их строение и функция излагались ранее в гл. «Липиды») преобладает липидный компонент, поэтому физико-химические свойства их характерны для липидов. В лнпополисахарндах преобладает углеводный компонент, поэтому в них ярче проявляются свойства углеводов. Липополисахариды входят в состав наружного слоя мембран бактерий, специфических рецепторов бактериофаге*. В отличие от гликолипидов липополисахариды растворяются в полярных растворителях, например в водных растворах фенола. Липополисахариды состоят из трех компонентов: особого липида — липида А, к которому ковалентно присоединен короткий гетерополисахарид (он называется кором липополиса- харида), и с последним, тоже ковалентно, соединен О-специфичный полисахарид. Лигтополисахариды обладают токсигенной активностью, антигенной и ре- цепторной функциями.
Металл пол ннуклеотиды. Комплекс металла с нуклеиновыми кислотами образуется с фосфатными группами и частично с основаниями. Катионы металлов влияют на стабильность и пространственную укладку нуклеиновых кислот, а следовательно, и на их функцию в клетке. Выше уже упоминалось, что нейтрализация отрицательно заряженных фосфатных групп катионами натрия, калия или двухвалентными катионами (магния, марганца) стабилизирует двойную спираль ДНК, препятствуя ее раскручиванию. Такие металл ополи ну клеотид- ные комплексы образуются между Мп2+, Со2+ и РНК, между Мп2+, Со2" [2]", Ni2+, Fe21" и ДНК. Большое значение в стабилизации рРНК имеют ионы калия.
Металлполисахариды существуют в организме животных и растений. Особенно типичны подобные комплексы для пектинов, содержащих уроновые кислоты. Вероятно, катионы металлов влияют на гелеобразование и гидрофнльность полисахаридов и, возможно, изменяют биологическую функцию последних в составе металлполнсахарндных комплексов.
ГЛАВА 8. ОРГАНИЗАЦИЯ СУБКЛЕТОЧНЫХ СТРУКТУР КЛЕТКИ
Молекулярные компоненты клетки: вода, неорганические вещества, белки, углеводы, пол ннуклеотиды, липиды, кофакторы и смешанные макромолекулы, рассмотренные в предыдущих главах, можно рассматривать как детали более сложных конструкций — надмолекулярных структур, органоидов и клетки в целом.
 Рис. 17 Схема строения мозаичной модели мечбраны (по Сэтиру)
Рис. 17 Схема строения мозаичной модели мечбраны (по Сэтиру)
|
Отсюда и название сандвичевой модели — «унитарная» мембрана. Были предложены и другие модели мембран — модель липидно-белкового ковра, в которой белки и липиды переплетены друг с другом, и мозаичная модель, учитывающая неодинаковое расположение белков в липидном слое.
Усовершенствованная мозаичная модель клеточной мембраны пока лучше всего объясняет ее функции (рис. 17). Липиды в ней образуют типичный бимолекулярный слой, состоящий из ненасыщенных фосфолипидов и холестерина. Состояние, в котором находятся липиды мембраны, называется жидкокристаллическим, поскольку в целом липидная прослойка жидкая, но в ней есть плотные участки, или участки затвердевания, похожие на кристаллические структуры. Конфигурация молекул фосфолипидов мембраны напоминает трость. Полярные головки фосфолипидов формируют ручку этой «трости», а стержень ее — неполярные хвосты, направленные навстречу друг другу. В мембранах больше фосфолипидов, несущих двойной отрицательный или общий нейтральный заряд (например, холинфосфатиды, сфингофосфатиды),
Молекулы холестерина гидрофильной спиртовой группой примыкают к полярным группам фосфолипидов, а кольцо стерана уходит в толщу липидного двойного слоя между углеводородными цепями фосфолипидов. Благодаря такой компоновке холестерин регулирует образование кристаллических/ структур Он мешает излишнему «затвердеванию» жидкой пленки, как бы разъединяя неполярные цепи фосфолипидов. В то же время участки с большим количеством «жидких» ненасыщенных цепей жирных кислот уплотняются холестерином. В норме это участки кристаллических структур липидного слоя.
Молекулы липидов мембраны находятся в постоянном движении. Возможны два типа перемещений молекул—это- «кувырок» (в научной литературе он называется «флип-флоп») и латеральная диффузия. В первом случае противостоящие друг Другу в бимолекулярном слое молекулы фосфолипидов переворачиваются (или совершают кувырок) навстречу друг другу и меняются местами в мембране, т. е. наружная становится внутренней и наоборот. Такие перескоки очень редки. Чаще наблюдаются повороты вокруг оси и латеральная диффузия. Последняя состоит в том, что соседние молекулы одного слоя меняются местами. Перемещения липидов в мембране имеют и физиологическое значение, например при замене отслуживших свой срок фосфолипидных молекул По вязкости лнпидная прослойка мембраны напоминает оливковое масло Если же она находится в более жидком состоянии или более плотном, чем в норме, то это вызывает нарушения функции мембран. Например, в клетках опухолей мембрана более жидкая. С другой стороны замена ненасыщенных фос- фолипидов на насыщенные при некоторых патологиях приводит к повышенному образованию плотных кристаллических структур, что снижает проницаемость мембран в десятки раз.
Другой важнейший строительный материал мембран — белок — контактирует с липидным бимолекулярным слоем по-разному. Согласно мозаичной модели мембраны имеются следующие варианты расположения белков:
1) по поверхности полярных головок фосфолипидов с обеих сторон бимолекулярного слоя (как в бутербродной модели);
2) белки частично утоплены в липидном слое и образуют комплексы с липидамк. Такой вариант расположения возможен для белков и наружной, и внутренней поверхностей мембраны;
3) белки полностью погружены в слой липидов, составляя вместе с ними как бы внутренний остов мембраны. Такие белки образуют с липидами комплекс, похожий на протеолипиды;
4) белки насквозь прошивают мембрану. Средняя часть белковой макромолекулы контактирует с лнпидами, а ее концы обращены внутрь клетки и во внешнюю среду. Как правило, наружная поверхность некоторых белков, особенно прошивающих насквозь мембрану, модифицируется углеводами. Эти гликопротеиды несут специфические группы, узнающие другие клетки и обладающие антигенными свойствами.
Белки поверхностного слоя прикрепляются к полярным головкам фосфолипидов с помощью электростатических сил или через молекулы структурно связанной воды. Белки, погруженные в липиды, относятся в отличие от поверхностных к амфипатическим. Их погруженная часть образует с липидами мембран гидрофобные связи, а выступающие части взаимодействуют с молекулами воды. Белки, находящиеся в толще мембран, называются структурными". Они содержат большое количество неполярных аминокислот.
Расстояние между проникающими глобулярными белками равно примерно 300 липидным молекулам. В промежутках между ними строение мембраны похоже на унитарную модель, а в местах проникновения белков — на ковровую. Белки как бы плавают в липидном слое и перемещаются по типу латеральной диффузии.
Состав липидов разных мембран неодинаков и определяет особенности их функций. Можно выделить несколько групп белков плазматических мембран:
1) антигенные белки, которые определяют специфику поверхности клетки и ее взаимодействие с антителами. Чаще всего это гликопротеиды или глико- протеолипиды;
2) структурные белки, находящиеся в толще мембраны. Считают, что эти неполярные белки вместе с двойным слоем липидов являются информативной основой для сборки остальных частей природных мембран;
3) рецепторные белки, которые находятся снаружи плазматической мембраны. Они или погружены в липидный слой, или находятся на поверхности липидной пленки. Набор этих белков определяет специфичность ответа биохимических процессов клетки на внешние регуляторы (например, на гормоны, медиаторы и т. д.);
4) ферментные белки, которые находятся и в поверхностных слоях, и погружены в липидный слой. Набор ферментов определяет функции как плазматической, так и внутриклеточных мембран органоидов;
5) транспортные белки, участвующие в переносе веществ через мембрану (часть из этих белков имеет ферментативную природу). Наружная поверхность клеточных мембран имеет отрицательный заряд по отношению к внешней среде. Она окружена слоем противпионпв
Молекулярная архитектура мембран и состав ее компонентов говорят о том, что это очень динамичные структуры. Уже оставлены бытовавшие представления, что мембраны всего лишь перегородки, не дающие вытекать внутриклеточному содержимому и ограничивающие влияние внешних факторов.
Сложная структура мембран позволяет им обеспечивать многие фундаментальные процессы жизнедеятельности, что невозможно для отдельны? макромолекул и других надмолекулярных комплексов.
Биологические функции биологических мембран. Можно отметить следующие функции биомембрап
1) Разделительная, так как мембраны разделяют внутри- и внеклеточное пространства
2) Интегративиая, ила объединяющая Мембраны объединяют отдельные рачрозненные биохимические процессы в единое структурное целое, являясь своеобразными коммуникациями между разными участками клетки.
3. Транспортная — они участвуют в переносе веществ между различными пространствами клетки и внеклеточной средой
4. Осмотическая Зга функция по концентрированию веществ (например, катионов Na4" и К +) между внутри- и внеклеточным пространствами.
5. Электрическая. Благодаря мембранам создаются условия для неравномерного распределения зарядов по обе стороны ее, что приводит к возникновению разности электрических потенциалов.
6 Энерготрансформирующия. Мембрана обеспечивает трансформацию электрической и осмотической энергии в химическую энергию АТФ Без мембран выполнение.этой функции невозможно.
7. Рецепторная. Мембрана воспринимает сигналы из окружающей среды благодаря наличию на ее внешней поверхности специальных белков-рецепторов, Воспринятый сигнал передается внутрь клетки. Причем воспринимаются через рецепторы не только химические, но и фотосигналы (например, фото- рецептпрами сегматк: < глаза).
8 Регуляторная. Мембраны участвуют 8 образовании внутриклеточных регуляторов обмена веществ — 3', 5'-АМФ и 3', 5'-ГМФ.
9 Метаболическая ферменты мечбраи участвуют в различных преара- шениях как природных, так и чужеродных веществ.
10 Антигенная. Гликопротеиды клеточных мембран определяют их спо- |о6ность вызывать образование специфических антител.
П Адгезивная. Адгезия, или контакт с другими клетками, зависит от узнающих зон, содержащих углеводные компоненты.
2. Характеристика и функции органоидов клетки
Органоиды — более сложноорганизованные структуры, чем мембран Поэтому функции их более разнообразны (табл. 18).
Характеристика структуры и.функций органоидов
структура
Округлой формы, диаметрпм 4— 6 мкм. Имеет мембрану с крупными порами, но не проходимыми для низ- комол екулярных веществ. Во внутреннем содержимом (кариоплазме) локализуются хромосомы. Зоны уп- лотненйя — ядрышки - содержат ДНК и богаты РНК
В клетке имеется в среднем 500— 800 митохондрий. Форма палочковидная, размеры 0, 5—2, 0 мкм Имеют наружную и внутреннюю мембраны. Последняя образует гребни— крнсты. Пространство между крис- тами называется матриксом. Митохондрии содержат ДНК
Округлой формы, диаметром 0, 5 мкм. Окружены одинарной мембраной. Центральная часть имеет кристаллическую плотную массу, возможно, состоящую из ферментов. Содержат пероксидазу, каталазу, окендазу D-аминокислот, - уратоксидазу и некоторые другие ферменты
Округлой пузырьковидной формы, диаметром 0, 25—0, 5 мкм. Окружены одинарной мембраной. Содержат гидролитические ферменты. Лизосо- мамн богаты макрофаги, растущие клетки (эмбриональные)
Сеть канальцев и цистерн, пронизывающих цитоплазму клетки; канальцу имеют типичные ме»брань>, к «я. Ружной поверхности которых участками прикреплены рибосомы (отсюда название этих участков — шероховатые мембраны). Рибосомы
Хранение и передача i информации при делении клетки и в процессе жизнедеятельности. В ядре образуются все виды РНК, в ядрышке — рРНК.
Участвуют в передаче генетической информации в Синтезе белка. Основная функция состоит в окислении конечных продуктов белков, липндов и углеводов с помощью кислорода, в переносе электронов и трансформации энергии. За ведущую роль в образовании энергии их называют «энергетическими станциями» клетки
Выполняют окислительные функции, нмея в составе ферменты, окисляющие D-амннокнслоты, мочевую кислоту. Участвуют в обезвреживании перскснда водорода и радикалов кислорода, которые очень агрессивны для биологических структур
Участвуют в переваривании (гидролизе) внутриклеточных веществ и крупных молекул, захватываемых клеткой. Играют роль в активировании белковых молекул путем отщепления неактивных фрагментов поли- пептндной цепи, а также в обновлении макромолекул. Имеются данные об участии лнзосом в синтезе белков
|
|