
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Классификация конденсированных сред по типам связей
|
|
ТИПЫ СВЯЗЕЙ В КРИСТАЛЛАХ
Существование стабильных связей между атомами в твердом теле предполагает, что полная энергия кристалла меньше полной энергии соответствующего количества свободных атомов (удаленных друг от друга на большие расстояния). Разность этих двух энергий называется энергией химической связи или просто энергией связи.
Силы, которые связывают между собой атомы, по своей природе почти полностью электрические, роль магнитных взаимодействий незначительна ( эВ/атом), а гравитационных – почти нулевая. Даже для наиболее тяжелых атомов она будет составлять
эВ/атом), а гравитационных – почти нулевая. Даже для наиболее тяжелых атомов она будет составлять  эВ/атом.
эВ/атом.
Однако необходимо отметить, что учет только лишь электростатического взаимодействия не позволяет объяснить устойчивость кристалла. Действительно, согласно теореме Ирншоу[1], устойчивая статическая конфигурация электрических зарядов невозможна. Поэтому необходимо учитывать и силы, которые имеют квантово-механическую природу.
Классификация конденсированных сред по типам связей
Из агрегатных состояний вещества два – твердое и жидкое – называются конденсированными.
Все виды связи между атомами обусловлены притяжением или отталкиванием электрических зарядов. Тип и сила связи определяются электронным строением взаимодействующих атомов. Независимо от природы сил, которые возникают при сближении атомов, их характер остается одинаковым: на больших расстояниях преобладающими являются силы притяжения, на малых – силы отталкивания. На некотором (равновесном) расстоянии 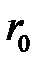 результирующая сила обращается в нуль, а энергия взаимодействия достигает минимального значения (рис.2.1).
результирующая сила обращается в нуль, а энергия взаимодействия достигает минимального значения (рис.2.1).
Твердым телом называют агрегатное состояние вещества, которое характеризуется стабильностью формы и колебательным характером теплового движения атомов. Следовательно, последние обладают кинетической энергией.
Задача о взаимодействии, даже самых простых, атомов, очень сложная, потому что приходится рассматривать поведение многих частиц – ядер и электронов. Необходимо учитывать волновые свойства микрочастиц, в первую очередь электронов, и решать приближенными методами соответствующее уравнение Шредингера[2].
Межатомная связь сопровождается существенной перестройкой валентных электронов атомов, и характер перестройки определяется природой самих атомов и состоянием электронов, которые принимают участие в образовании химической связи. Основной вклад в энергию образования твердого тела из атомов вносят валентные электроны, вклад электронов внутренних оболочек является незначительным.
| Рис.2.1. Потенциал межатомного взаимодействия |
В результате взаимодействия валентных электронов образуются общие электронные пары. Ковалентная связь возникает тогда, когда электронная пара не полностью смещена к одному из атомов, а локализована на общей для обоих электронов орбите.
Когда пара электронов практически полностью смещена к одному из атомов, имеем пример ионной связи. То есть, ионную связь можно рассматривать как крайний случай ковалентной связи. В этом случае энергию взаимодействия в кристаллах с такой связью можно вычислять на основе кулоновского взаимодействия положительных и отрицательных ионов, которые образовались в кристалле в результате перераспределения электронов между атомами.
Металлическую связь также можно рассматривать как крайний случай ковалентной связи, когда валентные электроны становятся коллективизированными, то есть одновременно принадлежат многим атомам.
В атомах с заполненными валентными оболочками распределение электрического заряда сферическое, поэтому они не обладают постоянным электрическим моментом. Но за счет движения электронов атом может превратиться в мгновенный электрический диполь, что приводит к возникновению так называемых ван-дер-ваальсовых сил. Например, в атоме водорода средний электрический момент равняется нулю, тогда как мгновенный момент может достигать 2, 5 D (дебай[3]). При сближении атомов возникает взаимодействие мгновенных атомных диполей.
Главными характеристиками химической связи является энергия, длина, полярность, кратность, направленность, насыщенность. Для ионной связи необходимо принимать во внимание эффективный заряд ионов.
По характеру сил связи твердые тела можно разделить на следующие классы: атомные, ионные, металлические, молекулярные кристаллы и кристаллы с водородной связью.
|
|