
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Силикаты в кристаллическом состоянии
|
|
2.1. Запись формул силикатных структур
История развития химии силикатов включает в себя несколько этапов.
Первая классификация силикатов, а с ней и запись формул силикатных минералов, основывалась на отношении числа атомов кислорода, связанных с кремнием, к числу атомов кислорода, связанных с другими элементами.
Формулы силикатов при этом записывались в виде оксидов, составляющих структуру, в последовательности нарастания валентности катионов и в последнюю очередь записывался оксид кремния. На основе этих формул строят названия силикатных соединений:
калиевый полевой шпат – K2O*Al2O3*6SiO2 – алюмосиликат калия;
двухкальциевый силикат – 2*CaO*SiO2 – силикат кальция;
форстерит – 2*MgO*SiO2 – силикат магния;
анортит – CaO*Al2O3*2SiO2 – алюмосиликат кальция.
Второй этап связан с представлениями о силикатах, как о солях поликремниевых кислот. Исходной считалась отрокремниевая кислота H4SiO4. Поликремниевые кислоты выводились из нее по уравнению n*H4SiO4m*H2O. При m=n=1 – метакремниевая кислота H2SiO3, m=1, n=2 – ортодикремниевая кислота H6Si2O7 и т.д.
В формуле записи силикатных структур этим способом располагаются последовательно атомы одно-, двух- и трехвалентных металлов, затем кремний и в последнюю очередь кислород:
калиевый полевой шпат – K*Al*Si3*O8;
двухкальциевый силикат – Ca2*SiO4;
форстерит – Mg2*SiO4;
анортит – Ca*Al2*Si2O8.
Современные представления о структурах силикатов основаны на наличии характерных для кристаллической решетки кремнекислородных или алюмокремнекислородных групп, которые при записи формул выделяются прямыми скобками. В круглые скобки заключаются изоморфно замещающие друг друга катионы:
калиево-натриевый полевой шпат – (K*Na)*[Al*Si3*O8];
двухкальциевый силикат – Ca2*[SiO4];
оливины – (Mg*Fe)*[SiO4];
анортит – Ca*[Al2*Si2O8].
При записи формул силикатных структур используются следующие общепринятые сокращения: SiO2 – S, Al2O3 – A, CaO – C, Fe2O3 – F, H2) – H.
Например, минералы портландцементного клинкера могут быть записаны следующим образом: 3*CaO*SiO – C3S; 4*CaO*Al2O3*Fe2O3 – C4AF и тому подобное.
2.2. Особенности структур силикатов
Кристаллохимические исследования силикатов показали, что они не имеют молекул, а их структура образована ионами, то есть силикаты обладают ионными кристаллическими решетками.
1. В основе структур силикатов лежит кремнекислородный тетраэдр [SiO4]. Различные по форме сочетания взаимосвязанных кремнекислородных тетраэдров называют кремнекислородными мотивами.
2. Кремнекислородные тетраэдры соединяются друг с другом вершинами через кислород, образуя силоксановую связь Si – O – Si. Эта связь на 50% ионная; энергия связи составляет 470 кДж/моль. Связь тетраэдров осуществляется только через кислородные вершины и это приводит к образованию устойчивых структур.
3. Для силикатных структур характерным является замещение катиона кремния на катион алюминия. При координационном числе 4 алюминий может замещать кремний в кремнекислородном мотиве, алюминий с координационным числом 6 играет роль связующего катиона между мотивами. В первом случае силикаты получили название алюмосиликатов, во втором – силикатов алюминия.
4. В силикатных структурах развит изовалентный и гетеровалентный изоморфизм.
5. Большинство структур силикатов не подчиняются закону плотнейших упаковок.
2.3. Структурная классификация силикатов
В основу структурной классификации силикатов положен способ объединения тетраэдров в кристаллической решетке. Согласно этой классификации, предложенной Bregg, Mahazki, силикаты разделяются на группы следующим образом:
· островные силикаты с изолированными тетраэдрами;
· силикаты с обособленными комплексами тетраэдров;
· цепочечные силикаты;
· ленточные силикаты;
· слоистые силикаты;
· каркасные силикаты.
 |
К островным силикатам относят структуры, в которых кремнекислородные тетраэдры соединяются друг с другом через катионы калия, натрия, кальция, магния, двухвалентного железа и др. Примером таких структур может служить структура форстерита, решетка которого относится к изолированным силикатам с тетраэдрами [SiO4], связанным друг с другом катионами магния.
Изолированные тетраэдры называют ортогруппами, а силикаты на их основе – ортосиликаты, для которых обычно (но не обязательно) отношение кислорода к кремнию равно или более 4.
Из технических продуктов к ортосиликатам кальция относят силикатные минералы портландцементного клинкера: C3S, β -C2S.
К силикатам с обособленными комплексами тетраэдров относятся:
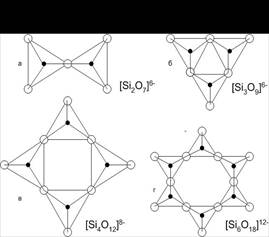
а) диортосиликаты, в которых два тетраэдра соединяются через одну кислородную вершину, образуя комплекс [Si2O7] (рис.4), например минерал доменных шлаков геленит (алюмосиликат кальция) Ca2*Al*[Al*Si*O7], продукты гидратации минералов портландцементного клинкера гидросиликаты кальция переменного состава Ca2*[Si2*O7]*(OH)n.
Диортогруппы играют важную роль в образовании структур силикатов с крупными катионами, соединяющими их в кристаллической решетке.
б) кольцевые силикаты образуются путем соединения кремнекислородных тетраэдров в кольца переменного состава (рис.4). Соединение колец друг с другом приводит к образованию объемных элементов структуры силикатов.
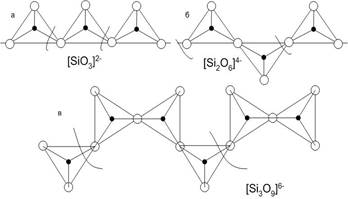
В цепочечных силикатах кремнекислородные тетраэдры связаны между собой в бесконечную цепочку сильной силоксановой связью (рис.5). Между собой цепочки соединяются катионами магния, железа, кальция, натрия. Цепочечные силикаты получили название метасиликатов.
Ленточные силикаты возникают при конденсации двух цепочек с образованием из двух кислородных вершин одной общей. Наибольшее распространение в силикатах подобной структуры получила амфиболовая лента, состоящая из двух пироксеновых цепочек. В ленточных силикатах всегда отмечается присутствие ионов фтора или хлора. Ксонотлитовая лента (рис.6) лежит в основе структуры слоистых гидросиликатов кальция, играющих важную роль при формировании структуры строительных конгломератов на основе портландцементного клинкера, например, фогашита Ca8[Si6O17]*(OH)6.
Рис.4. Силикаты с обособленными комплексами тетраэдров: а – диортосиликаты; б, в, г – кольцевые силикаты
Рис.5. Типы структур силикатных цепочек: а – метагерманатная, б – пироксеновая, в – воллостанитовая
 |
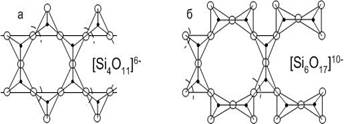 |
Рис.6 Структура ленточных силикатов: а – амфиболовая лента; б – ксонотлитовая лента
Структурной основой слоистых силикатов (рис.7) являются кремнекислородные слои (сетки). Это бесконечные в двух направлениях плоские радикалы с тетраэдрами, обладающими тремя общими с тремя соседними тетраэдрами кислородными вершинами. Четвертая вершина направлена от слоя и служит соединительным мостиком (через катионы) с другим слоем.
В целом слои формируют пакеты: открытого типа, если соединительные катионы включают гидроксильную группу, и закрытого типа во всех остальных случаях.
Связь внутри пакета осуществляется электровалентными силами, между пакетами – межмолекулярным взаимодействием. Такой характер химических связей определяет свойства слоистых силикатов, для которых наблюдается ярко выраженное пластинчатое строение.
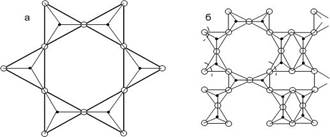 |
Рис.7. Типы структур слоистых силикатов: а – тальк, б – тоберморит
В основе структуры слоистых силикатов находится кремнекислородный мотив [Si4O10]:
тальк Mg(OH)2*[Si4O10];
каолинит Al4(OH)8*[Si4O10];
мусковит K*Al2(OH)2*[Al*Si3O10].
Структура глинистого минерала каолинита относится к пакетам открытого типа (рис.8). Связь между гидроксильной группой одного слоя и кислородом другого водородная, поэтому каолиниты относятся к малопластичным материалам, не склонным к набуханию.
В монтмориллоните Al2*[Si4O10]*(OH) * nH2O, структура которого симметрична структуре каолинита по плоскости катионов алюминия, формируется пакет закрытого типа. Связь между пакетами слабая. Адсорбционная способность монтмориллонита значительно выше, чем у каолинита, также выше пластичность, набухание при увлажнении, что следует учитывать при разработке технологических процессов производства керамических материалов на основе этих минералов.
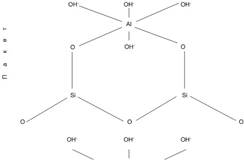
Рис.8. Структура каолинита
В каркасных структурах силикатов трехмерные радикалы возникают при бесконечном объединении свободных кислородных вершин сеток, при этом каждый кислород связан только с катионом кремния. В этом смысле можно говорить о полимеризации кремнезема. Силикаты подобного типа (кварц и его разновидности) обладают большой прочностью и твердостью.
В общем случае структура каркасных силикатов электронейтральна. Если же катионы кремния замещаются на алюминий, то мотив приобретает электроотрицательный заряд, который компенсируется добавочными катионами калия, натрия, кальция, которые размещаются в пустотах каркасных алюмосиликатов. Общая формула таких структур [AlxSin – xOn].
К каркасным силикатам относятся нефелин Na*[AlSiO2], полевые шпаты, цеолиты.
Нефелин используется при производстве содопродуктов, цемента, стекла.
Цеолиты – водные алюмосиликаты. При нагревании цеолитов вода удаляется из полостей кристаллической решетки постепенно, не разрушая кристаллической решетки. Оводнение цеолитов затем может происходить во влажной среде. Это свойство минералов используется при изготовлении осушителей. Способность цеолитов пропускать через кристаллическую решетку молекулы строго определенных размеров обуславливает их использование в качестве молекулярных сил.
2.4. Твердые растворы. Изоморфизм
Тердыми растворами называют однородные системы переменного состава, состоящие из двух или более компонентов.
Отличие твердых растворов от химических соединений состоит в следующем:
1. в кристаллической решетке химического соединения элементы расположены в строгой закономерности (в твердых растворах расположение элементов носит вероятностный характер);
2. состав химического соединения постоянен, состав твердого раствора может меняться в широких пределах.
Так, например, доломит Ca*Mg*(CO3) – химическое соединение, природный минерал. Катионы кальция и магния чередуются в узлах кристаллической решетки вдоль оси кристалла, состав соединения постоянен. Оливины – ряд твердых растворов, имеющих формулу (Mg, Fe)*[SiO4], крайними членами которого являются форстерит Mg*[SiO4] и фаялит Fe*[SiO4]. Взаимозаменяемость катионов магния и железа у оливинов может составлять 100%.
Твердые растворы образуются путем замещения катионами друг друга, внедрения в кристаллическую решетку катионов ионного типа, изъятие из узлов кристаллической решетки катионов.
В твердых растворах замещения элементы одного вещества замещают в узлах кристаллической решетки элементы другого вещества. Такое явление получило название изоморфизм.
При замещении образуются гомогенные фазы переменного состава. Изоморфизм возможен при соблюдении следующих условий:
1. наличие одинаковых зарядов взаимозамещающих катионов (групп катионов);
2. одинаковый тип химической связи взаимозамещающих катионов;
3. близость ионных радиусов взаимозамещающих катионов (отклонение величин ионных радиусов не должно превышать 15%).
Последнее условие является обязательным при так называемой неограниченной растворимости: 100% замещении одного катиона другим.
Различают два вида изоморфизма.
При изовалентном происходит замещение равнозарядных ионов Kn 1= Kn2.
Примером может служить замещение в оливинах магния на железо, взаимозамена в гранатах кальция, магния и двухвалентного железа на алюминий, трехвалентное железо и кобальт.
При гетеровалентном изоморфизме замещаются разнозарядные катионы
Kn1 + Km2 = Kp3 + Kq4 при m + n = p + q или
2Kn1 = Km2 + Kp3 при 2n = m + p.
В плагиоклазах, твердых растворах альбита Na*[Al*Si3O8] и анортита Ca*[Al2Si2O8] происходит замещение натрия и кремния на кальций и алюминий с равной суммой зарядов взаимозамещающих катионов.
Параметры кристаллической решетки являются функцией химического состава твердых растворов и линейно изменяются с изменением состава. Это правило получило название правила Вегарда. Из него вытекает возможность построения зависимости ² состав–свойство² и использование этой зависимости в практике для определения свойств твердых растворов по известному составу или наоборот.
В твердых растворах внедрения частицы одного элемента располагаются в междоузлиях кристаллической решетки. Как правило, внедряются атомы малых геометрических размеров: водород, азот, углерод.
В твердых растворах вычитания в процессе их образования остаются незаполненные структурные позиции кристаллической решетки.
|
|