
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Общая характеристика d-элементов
|
|
К d-элементам относятся 32 элемента периодической системы с III по II группы побочных подгрупп. Валентные электроны расположены на ns2 (n–1)da, где а = 1 до 10, то есть они находятся на предвнешнем энергетическом уровне.
В побочных подгруппах в направлении сверху вниз уменьшается радиус атома за счет «d-сжатия», возрастает энергия ионизации, что приводит к снижению химической активности металлов.
Все атомы d-элементов, за исключением II Б подгруппы имеют незавершенный d-подуровень, поэтому они проявляют разные степени окисления, но высшая степень окисления соответствует номеру группы, в которой находится элемент.
При проявлении разных степеней окисления у элемента проявляется следующая закономерность: низшие степени окисления обуславливают основные и восстановительные свойства, в высших - проявляются кислотные и окислительные свойства, амфотерный характер типичен для элементов в промежуточными степенями окисления. У d-элементов отсутствуют отрицательные степени окисления. В побочных подгруппах в направлении сверху вниз увеличивается устойчивость соединений с наибольшей степенью окисления.
В организме человека d-элементы находятся, как правило в низших степенях окисления, соединения с высшими степенями окисления очень токсичны. Шесть элементов d-семейства составляют второй остров «металлов жизни» (Fe, Co, Mn Cu, Zn, Mo). «Металлы жизни» в организме находятся в виде катионов и располагают вакантными (акцепторными) атомными орбиталями и являются комплексообразователями, образуя аквакомплексы, а чаще внутрикомплексные соединения, называемые биокластерами. В живых организмах большинство катионов d-металлов связано с белками, что определяет структуру и функцию ферментов. Ферменты, благодаря их трехмерной структуре работают как высокоспецифические катализаторы с огромным каталитическим эффектом. Но такие d-элементы, как ртуть и кадмий являются ингибиторами, а порой каталитическими ядами для ферментов.
Ниже описано биологическое действие важнейших элементов d-блока.
Железо Общая масса железа в организме взрослого человека примерно 5г, что составляет 0, 007%. Наиболее важными железосодержащими соединениями являются: гемоглобин, включающий железо в форме (Fe2+), ферменты (каталаза и пероксидаза, содержащие ферри-форму (Fe3+), 50 видов цитохромов, в активном центре которых может содержаться как Fe2+, так и Fe3+.
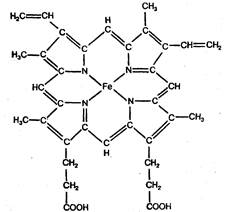
Гемоглобин – это сложный белок, в котором в качестве простетической (небелковой) группы содержится гем, представляющий собой бионеорганический комплекс Fe2+ с полициклическим органическим веществом – порфирином. Ион железа имеет координационное число 6. Гемоглобин обратимо связывает кислород и переносит его от легких к тканям.

 [Hb´ Fe2+] + О2 [HbFe2+´ O2]
[Hb´ Fe2+] + О2 [HbFe2+´ O2]
Дезоксигемоглобин Оксигемоглобин
Благодаря оксигемоглобину 1 литр крови переносит 250 мл кислорода. При вдыхании «угарного газа», СО связывается с гемоглобином и оксигемоглобином с образованием в 210 раз более устойчивого комплекса карбоксигемоглобина НHbCO. В связи с этим происходит отравление организма.
HHb+CO ¾ ® HНbCO;
HHbO2 + CO ¾ ® HHbCO + O2
Смертельно опасная концентрация СO составляет 2 мг/л при 60 минутной экспозиции и 5 мг/л - при 5 минутной. Отмечается высокое содержание (HHbCO) в крови курильщиков, которое может достигать 5% (от содержания гемоглобина), тогда как у некурящих его уровень не превышает 0, 3-0, 5%.
При действии нитритов, нитратов, NO2, H2O2, O3 происходит окисление в гемоглобине катиона Fe2+ до Fe3+, что приводит к образованию метгемоглобина (метHHb), неспособного переносить кислород.

 HHb(Fe2+) ¾ ® мет HHb(Fe3+) + H++е
HHb(Fe2+) ¾ ® мет HHb(Fe3+) + H++е
восстановитель окислитель
Нитраты в организме восстанавливаются до нитритов, способных окислять (HHb) с образованием NO и различных активных форм кислорода
HHb(Fe2+)+NO2-+2H+ ¾ ® метHHb(Fe3+)+NO+H2O
HHb + NO ¾ ® HНbNO (нитрозогемоглобин).
В состав цитохромов (ЦХ) - ферментов класса оксидоредуктаз, входит железо или медь. ЦХ обеспечивают работу электронотранспортных цепей при окислительном фосфорилировании:
 ЦХ+Fe3+ +1 e ¾ ЦХ´ Fe2+;
ЦХ+Fe3+ +1 e ¾ ЦХ´ Fe2+;
 ЦХCu2+ +1 e ЦХCu+
ЦХCu2+ +1 e ЦХCu+
Каталаза - фермент, ускоряющий разрушение пероксидов (Н2О2, ROOH), имеют в структуре Fе3+. 1 молекула каталазы разлагает 44000 молекул Н2О2 за 1 секунду.
2 Н2О2 + каталаза ¾ ® 2Н2О+О2
Фермент пероксидаза ускоряет реакцию окисления органических веществ с участием Н2О2 .
В органах и тканях имеется депонированное (запасенное) железо, которое используется при его дефиците. Железо запасается с помощью белка ферритина и может транспортироваться через мембраны в виде железосодержащих белков трансферринов или в виде комплексов с аминокислотами.
В организм человека железо поступает с пищей. Пищевые продукты животного происхождения содержат железо в наиболее легко усвояемой форме. Большое количество железа содержится в говядине, печени, рыбе (тунец), горохе, листовой зелени. Суточная потребность в железе составляет 1 мг, при его недостатке возникает железодефицитная анемия.
В медицине препараты на основе различных солей двух- и трехвалентного железа, а также железосодержащие БАД применяются для восполнения относительного или абсолютного дефицита железа в ситуациях, связанных с увеличенной потребностью организма в этом биоэлементе (беременность, лактация, кровопотери, периоды роста и развития).
Кобальт является жизненно необходимым микроэлементом для человека и животных. Кобальт, в виде иона Co3+ входит в структуру витамина В12 (цианокоболамина).Витамин В12 является сложным азотсодержащим органическим комплексом трехвалентного кобальта с координационным числом шесть. Кобальт занимает в цианкобламине такое же положение, как железо в гемоглобине. Витамин В12 является переносчиком метильных групп, ионов водорода. При этом происходит окислительно-восстановительная реакция: + е
 HR·Co3+ R·Co2+ + H+
HR·Co3+ R·Co2+ + H+
Кроме процессов кроветворения кобальт влияет на минеральный, углеводный, белковый и жировой обмен. Витамин В12 необходим для нормального кроветворения и созревания эритроцитов, синтеза аминокислот, белков, РНК, ДНК и других соединений, без которых нормальное развитие организма невозможно. Кобальт активирует некоторые ферменты, например, карбоангидразу, карбопепсидазу, фосфатазу, каталазу, карбоксилазу, угнетает цитохромоксидазу и синтез тироксина. Со2+ является переносчиком метильных групп и протонов.
Накапливается витамин В12 в печени. Его недостаток в организме вызывает злокачественную анемию. Растения и животные не могут синтезировать витамин В12. Его вырабатывают лишь некоторые виды бактерий. В желудочно-кишечном тракте человека такие бактерии имеются. Они синтезируют достаточное количество витамин В12.

Цианокобаламин
Злокачественная анемия связана с нарушением всасывания этого витамина в кровь. Поэтому прием таблеток мало эффективно. Инъекция (100 – 200 мкг в течение двух суток) в кровь существенно улучшает состояние больного при злокачественной анемии. Избыток кобальта может вызвать кардиомиопатию, может проявляться эмбриотоксическое действие (вплоть до внутриутробной гибели плода). Суточная потребность составляет около 3 мкг. Источниками является печень, говяжье сердце, почки, а также моллюски, устрицы, сардины, из растений – шиповник. В меньшем количестве содержится в молоке, хлебе, овощах, бобовых культурах.
В медицине соли кобальта в составе витаминно-минеральных комплексов используются для лечения и профилактики различных заболеваний. Витамин В12 используется при лечении анемий: постгеморрагических и железодефицитных, вызванных токсическими и лекарственными веществами, при заболеваниях нервной системы, кожных болезнях. Хлористый кобальт в виде 20 % раствора используется при лечении гипертонической болезни. Радиоактивные изотопы кобальта применяют в радиоизотопной диагностике и при лучевой терапии.
Медь относится к металлам жизни. Общая масса меди в организме человека примерно 100 – 200 мг, что составляет около 10-4 %. Примерно 30% микроэлемента содержится в мышцах. Печень и мозг, трубчатые кости, надпочечники, половые железы также богаты медью. Медь входит в состав более 25 медьсодержащих белков и ферментов, называемых оксигеназами (Е1) и гидроксилазами (Е), активирующих процесс окисления органических соединений. Гидроксилазы (Е) присоединяют только один атом кислорода:
Е+О2 ¾ ® Е-О- + [O]
Оксигеназы (Е1) присоединяют оба атома кислорода с образованием пероксидной цепочки:


 O-
O-
[Е1´ Сu+] + О2 ¾ ® Е1´ Cu2+ +R–CН2–OH ®R–COOH+[E1´ Cu+]+ H2O
Фермент O- Субстрат
Медьсодержащие ферменты, катализирующие окислительно-восстановительные реакции с переносом электронов и Н+, называются оксидазами. К ним относят цитохромоксидазу (ЦХО), которая катализирует завершающий этап тканевого дыхания за счет переноса электронов на кислород.
| 4Н++4[ЦХО´ Cu+] + O2 ¾ ® 4[ЦХО´ Cu2+] + 2H2O |
Медьсодержащая супероксиддисмутаза (СОД) ускоряет разложение супероксид-иона О2- по схеме:
[СОД´ Cu2+] + O2- ¾ ® [СОД´ Cu+] + O2
[СОД´ Cu+] + O2- + 2Н+ ¾ ® [СОД´ Cu2+] + H2O2,
Образующийся пероксид водорода менее токсичен, разлагается каталазой.
Известно, что 98 % ионов меди содержится в церулоплазмине [ЦПCu2+] - белке плазмы крови, регулирующим баланс меди, обеспечивающим выведение её избытка. Церулоплазмин катализирует окисление Fe2+ в Fe3+ по схеме:
О2 + 4 е- + 4Н+
Fe2+ + [ЦПCu2+] ¾ ® Fe3+ + [ЦПCu+] ¾ ¾ ¾ ¾ ¾ ¾ ®2H2O
(I) (II)
Церулоплазмин принимает участие в кроветворении. В дальнейшем II катализирует восстановление кислорода. Суточная потребность в ионах меди 2-3 мг, при избыточном поступлении возникает болезнь Коновалова-Вильсона, при недостаточном – медная анемия (лизуха или атаксия), которая выражается в бледности кожи, заметными венами, кишечными расстройствами, снижением устойчивости к инфекциям, хрупкостью костей, нарушением координации движения. Потребность в меди возрастает при воспалительных заболеваниях и склонности человека к болезням суставов. Медь, цинк и железо оказывают синергическое действие друг на друга. Поэтому при ликвидации дефицита одного из этих элементов важно включать в рацион питания источники двух других минералов.
Металлическая медь и ее соединения токсичны. Растворимые соли меди образуют нерастворимые комплексы (биокластеры хелатного типа) при взаимодействии с тиольными группами (связывание), и аминогруппами (блокирование) белков.
 |
Летальной дозой является 2 г CuSO4´ 5H2O. В организм медь поступает в основном с пищей.
Цинк относится к микроэлементам. В организме взрослого человека содержится 1, 8 г цинка, т.е. 2, 4∙ 10-3%. Цинк можно обнаружить во всех органах и тканях, но наибольшее его количество содержится в предстательной железе, сперме, коже, волосах, мышечной ткани, клетках крови. В организм цинк попадает с пищей. Биологическая роль цинка установлена около 120 лет назад, хотя ранозаживляющие свойства цинка были известны египтянам более 5000 лет назад. Цинк является кофактором большой группы ферментов (более 80 металлоферментов) и необходим для нормального протекания многих биохимических процессов. Цинк входит в состав инсулина, ферментов: карбоангидразы, карбопепсидазы, щелочной фосфатазы, алкогольдегидрогеназы, лактатдегидрогеназы, δ -аминолевулинатсинтетазы, коллагеназы.
Карбоангидраза катализирует обратимую гидратацию углекислого газа:
СО2 + Н2О ¾ ® Н2СО3 ¾ ® Н+ + НСО3-
Карбопепсидаза катализирует процесс гидролиза пептидной связи:
R1― CO― NH― R2 + H2O ¾ ® R1COOH + R2 NH2
С участием щелочной фосфатазы осуществляется гидролиз, либо перенос фосфорного остатка в реакциях фосфорилирования. Фермент принимает участие в процессах кальцифицирования костной ткани.
δ -Аминолевулинатсинтетаза –Zn –зависимый фермент, катализирующий ключевую реакцию биосинтеза порфиринового ядра гема. Порфириновый цикл входит в структуру гемоглобина, цитохромов, фермента каталазы, цианокобаламина (витамина В12). Цинк участвует в обмене фолиевой кислоты, оказывая влияние на кроветворение. С учетом указанных свойств объяснимо развитие анемии при недостатке цинка в организме.
Ионы цинка входят в состав алкогольдегидрогеназы – фермента, участвующего в процессах окислительно-восстановительного превращения спиртовой группы в органических субстратах, лекарственных препаратах и этиловом спирте. Указанный фермент играет ключевую роль в окислении этилового спирта до уксусного альдегида. От обеспеченности цинком зависит не только активность, но и количество фермента. Цинк оказывает влияние на предрасположенность организма к алкоголизму.
Цинк является структурным и функциональным компонентом одного из ферментов углеводного обмена – лактатдегидрогеназы, контролирующего обратимое превращение пировиноградной кислоты в молочную кислоту –завершающей стадии анаэробного метаболизма глюкозы.
Цинк включен в состав коллагеназы, участвующей в метаболизме коллагена - важнейшего компонента соединительной ткани, составляющей структуру костей, зубов, связок, стенок сосудов, кожи, вещества хрусталика глаза. Цинк-содержащим является ретинолсвязывающий белок крови, транспортирующий витамин А из печени к тканям. Витамин А влияет на процессы пролиферации, лежащие в основе язво- и ранозащивляющего действия витамина А. В присутствии цинка хорошо лечатся труднозаживающие, послеоперационные раны, ожоги, в том числе у больных диабетом или с нарушенным кровообращением.
Немаловажное значение имеет также разноплановое влияние цинка на процессы свободнорадикального окисления, протекающие в организме человека. Цинк (вместе с медью) является кофактором важного антиоксидантного фермента Zn, Cu-супероксиддисмутазы, препятствующей образованию чрезвычайно активных гидроксильных радикалов, синглентного кислорода, повреждающих биологические мембраны, белки, нуклеиновые кислоты. Способствуя обеспечению организма витамином А, проявляющим антиоксидантные свойства, цинк косвенно оказывает влияние на антиоксидантную систему организма. Кроме того, цинк является индуктором серусодержащих белков – металлотионеинов, связывающих тяжелые металлы. Показано, что металлотинеины проявляют антиоксидантную активность. Таким образом, цинк относят к антиоксидантным факторам репаративного действия, оказывающим благотворное влияние на состояние кожи, зрения, определяющим противовоспалительное, противоязвенное, рано- и язвозаживляющее действие элемента. При обогащении диеты цинком уменьшается концентрация окисленных липидов, в том числе атерогенных липопротеинов низкой плотности. Антиоксидантными эффектами объясняют защитное действие цинка на почки.
Исключительно велико влияние цинка на гормональные функции организма. Цинк влияет на продукцию и действие андрогенов и эстрогенов, продукцию и функцию инсулина, состояние тимуса и продукцию его гормонов, что тесно связано с функционированием иммунной системы организма. Известно влияние цинка на состояние половой функции у мужчин, включая активность половых гормонов и сперматогенез. Дефицит цинка отрицательно сказывается на функциях тестикул, вплоть до их атрофии (при длительном дефиците микроэлемента), уровне тестостерона в крови, обуславливая олигоспермию. Прослеживается прямая связь между уровнем цинка и потенцией у мужчин. В пожилом возрасте дефицит цинка может стать причиной гиперплазии простаты, вплоть до аденомы. Молекулярная основа этих процессов – функционирование цинка как ингибитора фермента 5ά -редуктазы, контролирующего восстановление тестостерона до дигидротестостерона и поддерживающего достаточный уровень полового гормона. Избыточный уровень дигидротестостерона как следствие дефицита цинка стимулирует пролиферативные процессы и разрастание простаты.
Потребность в цинке у мужчин выше, чем у женщин, поскольку мужской организм теряет со спермой значительное количество цинка, что без адекватного восполнения может привести к его дефициту. Применение диуретиков может привести к потерям цинка и проявлению его недостаточности. У женщин дефицит цинка в пожилом возрасте способствует прогрессированию остеопороза. В юношеском возрасте недостаток цинка приводит к нарушению обмена веществ в коже и появлению юношеских угрей. При этом препараты цинка в качестве средств профилактики и лечения заболевания весьма эффективны.
С цинком связано действие гормона инсулина. Процессы его биосинтеза, транспорт, биотрансформация и действие связаны с обеспеченностью организма цинком. Цинк имеет исключительное значение для регулирования обмен веществ в целом, а также для профилактики и лечения сахарного диабета.
Цинк жизненно важен для функционирования тимуса как железы, регулирующей иммунные функции организма. Цинк поддерживает состояние железы, не допуская ее инволюции с возрастом. Таким образом, цинк – один из важнейших микроэлементов, необходимых для нормального развития и функционирования иммунной системы организма.
Известны данные о роли цинка в функционировании мозга и его способностях к запоминанию и в поведенческих реакциях.
В медицине цинк применяют в радиоизотопной диагностике. Сульфат цинка используют при определении свертываемости крови. Соли цинка с аспарагиновой, пиколиновой кислотами широко применяются в дерматологии, эндокринологии, при лечении иммуноддефицитных состояний.
Суточная потребность в цинке составляет 10-15 мг, при беременности и лактации – 20-25 мг. Наибольшее содержание цинка в пищевых продуктах отмечается в устрицах (60-1000 мг/кг), мясе -20-40 мг/кг), рыбопродуктах (15-30 мг/кг), зерновых (25-30 мг/кг), семенах тыквы. Однако, фитиновая кислота, содержащаяся в зерновых и сое, связывает цинк и другие минералы в неусвояемые металлофитиновые производные.
Хром – жизненно важный микроэлемент, являющийся постоянной составной частью клеток всех органов и тканей. Характеризуется самым малым содержанием в организме 6 -12 мг хрома. Наибольшее количество хрома присутствует в печени, почках, кишечнике, щитовидной железе, хрящевой и костной ткани, в легких. В организме хром участвует в регуляции синтеза жиров и обмена углеводов, оказывает активное влияние на усвояемость глюкозы и уровень сахара в крови. Этот элемент получил название «фактора толерантности к глюкозе», поскольку обеспечивает нормальную активность инсулина. Хром участвует в регуляции работы сердечной мышцы и функционировании кровеносных сосудов. Биологическое действие проявляют только Сr3+, производные хрома VI обладают токсическими и канцерогенными свойствами (0, 25 – 0, 3 г бихромата калия вызывают летальный исход), соединения хрома III и хрома VI на хромовых производствах вызывают раздражение кожи и дерматиты.
В организм хром поступает с пищей, водой и воздухом. В желудочно-кишечном тракте всасывается лишь 25 % органических соединений хрома, усвояемость неорганических солей составляет всего 0, 5-0, 7 % от их количества, поступающего с пищей. Введение Cr3+ в рацион восстанавливает нормальную толерантность к глюкозе, вызывает снижение уровня холестерина, что является важным фактором профилактики атеросклероза. Предполагаемая суточная потребность составляет 200 мкг/сутки. Наибольшее количество хрома содержится в пекарских дрожжах, печени, пшеничной муке грубого помола.
В медицине изотопы хрома используются в радиоизотопной диагностике. Пиколинат и аспарагинат хрома используют в витаминно – минеральных комплексах.
Марганец. В теле взрослого человека содержится 12мг микроэлемента. В организме присутствует в виде ионов Мn2+ или его комплексов с белками, нуклеиновыми кислотами, АТФ, АДФ и аминокислотами. Марганец участвует в процессах аккумуляции и переноса энергии, в формировании скелета, в иммунных реакциях, в кроветворении, тканевом дыхании, участвует в синтезе витаминов группы В, в растениях – в синтезе витамина С и хлорофилла. Катион Мn2+ влияет на активность многих витаминов, ферментов и гормонов, Мn2+ входит в состав металлоферментов (аргиназы, фосфоглюкомутазы, пирувата, карбоксилазы, холинэстеразы) способствуют активации большого числа ферментов разных классов: трансфераз, гидролаз, изомераз. Ионы Мn2+ стабилизируют конформацию нуклеиновых кислот, участвуют в процессах репликации ДНК, синтезе РНК и белка. Марганец может входить и в состав неорганических соединений в организме, например, малорастворимый марганец магний пирифосфат МnМgР2О7. В организме магний и марганец могут замещать друг друга в биохимических процессах. Таким образом, биогенная функция ионов марганца имеет широкий спектр: оказывает влияние на кроветворение, образование костей, минеральный обмен, рост, размножение и некоторые другие функции. Еще одна особенность ионов Мn2+ - универсализм, так как он может выполнять каталитическую функцию подобно Cu2+, Fe2+, Zn2+, но в тоже время действовать подобно Мg2+ и Са2+. В отличие от Мn2+, , катион Мn3+ очень прочно связывается с белками, причем преимущественно с кислородными донорными группами, и поэтому Мn3+ совместно с Fe3+ входит в состав трансферина, супероксиддисмутазы и кислотной фосфотазы. т.е. в состав типичных металлопротеинов. Почти одинаковое значение атомного радиуса марганца и железа объясняет способность марганца замещать железо в порфириновом комплексе эритроцита. По той же причине марганец может замещать и цинк в цинкзависимых ферментах, изменяя при этом их каталитические свойства.
Особое значение Мg2+ имеет в реализации функции половых желез, опорно-двигательного аппарата, нервной системы. Считается, что микроэлемент оказывает защитное действие в отношении недостаточности венечных артерий сердца важен для профилактики диабета, патологии шишковидной железы, нарушений углеводного и липидного обмена. Суточная потребность – 5-7 мг, минимальная -2-3 мг. С возрастом усвояемость Мg2+ уменьшается, после 50 лет возможен дефицит этого элемента. Основной источник – злаковые, бобовые, орехи. Особенно богаты Мg2+ чай и кофе. 1 чашка чая содержит 1, 3 мг, однако его усвояемость составляет 37-63 % от его содержания в рационе.
В медицине наружно применяются водные растворы перманганат калия KМnO4 в качестве антисептического средства для полосканий, спринцеваний, смазывания язвенных и ожоговых поверхностей, промывания мочевого пузыря и мочевыводящих путей.
Молибден относится к металлам жизни, поступает в организм с пищей. В крови около 80 % молибдена связывается с белками и транспортируется по всему организму. Молибден концентрируется в печени, а в крови распределяется равномерно между форменными элементами и плазмой. В биохимических процессах молибден участвует в степенях окисления +5 и +6. Молибден входит в состав ферментов ксантиноксидазы, ксантингидрогиназы, альдегиддегидроксидазы, альдегидоксидазы, сульфитоксидазы, нитратредуктазы, участвующих в процессах детоксикации ксенобиотиков. Ксантиноксидаза (КОКС) катализирует окисление ксантина и гипоксантина до мочевой кислоты, альдегидов до кислот.
H2O
R–COH + KOKC·Mo6+ → H3O+OCR–KOKC·Mo4+ →
→ RCOOH + KOKC·Mo6+ +2H+
Избыточное содержание молибдена в пище нарушает метаболизм Са2+ и РО43-, вызывая снижение прочности костей - остеопороз. С кальцием анионы фосфорномолебденовых комплексов дают нерастворимые соли и эти кристаллики инициируют отложения солей мочевой кислоты, вызывая заболевания подагрой. Подагра деформирует суставы, оправдывая свой буквальный перевод как «капкан для ног».
Молибден способствует задержанию в организме фтора и, таким образом, препятствует развитию кариеса. Суточный прием – 200 мкг. Источниками являются печень, почки, горох, капуста цветная, зеленый горошек, пивные дрожжи, овес.
В медицине применяют радиоизотопы молибдена, изучается эффективность применения тетрамолибдата аммония для лечения новообразований головного мозга и мужского бесплодия.
Серебро. В организме взрослого человека обнаруживается около 1 мг серебра, т.е. примерно 10-6 %. Антисептические свойства растворимых солей серебра известны с древних времен. В воде, хранящейся в серебряных сосудах долго не развиваются микроорганизмы. Токсическое действие растворимых соединений серебра обусловлено взаимодействием ионов серебра с серо – и азотсодержащими группами белков, нуклеиновых кислот и других биоорганических веществ. Сильные токсические проявления у взрослого человека наблюдаются при приеме внутрь 7г АgNO3.В медицине используют такие препараты серебра, как АgNO3 (ляпис) и его водные растворы, препараты коллоидного металлического серебра протаргол (8% Аg) и колларгол (70% Аg). Препараты серебра применяют как противовоспалительные, антисептические и вяжущие средства.
Никель является микроэлементом. В организм соединения никеля поступают с пищей. Между тканями организма распределяется равномерно, только в легких его содержание с возрастом увеличивается. В плазме крови ионы никеля находятся в основном в связанном состоянии с белками. Депонируется никель в поджелудочной и околощитовидных железах. Никель оказывает влияние на ферментативные процессы, окисление аскорбиновой кислоты. Ускоряет переход сульфгидрильных групп в дисульфидные. Никель может угнетать действие адреналина, снижать артериальное давление, повышать гипогликемическую активность инсулина. Избыточное поступление в организм никеля может вызвать аллергию и депигментацию кожи (витилиго).
В медицине никель применяется при изготовлении имплантантов.
Кадмий - токсический примесный микроэлемент. В организме человека содержится 50 мг кадмия т.е. 7∙ 10-5%. Пищевыми источниками кадмия являются мидии и устрицы, злаки и листовые овощи. Кадмий аккумулируется в основном в почках, печени и двенадцатиперстной кишке. С возрастом содержание кадмия в организме увеличивается, особенно у мужчин. Физиологическая роль его изучена недостаточно. Кадмий обнаруживается в составе металлтионеина – белка, для которого характерно высокое содержание сульфгидрильных групп и тяжелых металлов. Соединения кадмия ядовиты.
В медицинских целях сульфат кадмия используют при проведении исследований свертываемости крови.
Ртуть относится к токсическим микроэлементам, порог токсичности 0, 4 мг, а летальная доза 0, 15 – 0, 3 г. В организме человека содержится 1мг ртути, т.е. 2 10-5%. Соединения ртути поступают в организм человека с морской рыбой, морепродуктами и рисом. Ртуть обнаружена во всех органах и тканях организма человека.
В природе наиболее распространены три формы ртути: элементная ртуть Hgo, двухвалентная Hg2+ и органическая форма - метилртутный катион СН3Hg+. Загрязнение окружающей среды соединениями ртути связанно с обогащением руд, процессами получения хлора, ртутных батарей, красок, пестицидов и т.д. Так, например, использование антиобрастающих красок для покрытия корпусов кораблей, вследствие прямого выщелачивания фенилртутных соединений ведет к загрязнению водной среды. Еще одним распространенным источником ртути являются люминесцентные лампы. Одна лампа содержит около 150 мг ртути и при разгерметизации способна загрязнить ртутью 500 тысяч м3 воздуха на уровне ПДК.
Металлорганические соединения обладают в целом большим токсичным действием, чем соответствующие неорганические соли. Органические соединения ртути относятся к классу суперэкотоксикантов. Образование высокотоксичных форм ртути происходит в природе путем алкилирования ионов ртути микроорганизмами и грибами. Схема процесса переноса метильной группы в присутствии специфического кофермента бактерий метилкобаламина:
CH3CoB12 + Hg2+ ® CH3Hg+ + H2OCoB+12
Соли ртути образуют комплексы с сульфгидрильными группами белков, содержащих цистеин, вызывают изменение их структуры и, как следствие, потерю активности фермента. Кроме того, в основе токсического действия ртути лежит образование связей с гемоглобином, цитохромом Р-450, рецепторами.
Причиной большей токсичности металлорганических соединений, по сравнению с неорганическими солями является наличие липофильных или гидрофобных групп R в молекуле. Это обеспечивает их распространение с током жидкости по всему организму и перенос через клеточные мембраны за счет диффузии, а также способность проходить через кровяной и плацентарный барьеры. Липофильность органических соединений ртути способствует их накоплению (кумуляции) в органах и тканях. Период полувыведения алкилпроизводных в 20-25 раз выше, чем у неорганических солей. Отравление организма человека метилированной ртутью проявляется в основном в нарушениях нервной системы, таких как онемение конечностей, ухудшение слуха, нарушение речи, и функций вестибулярного аппарата (болезнь Миномата).
Металлорганические соединения ртути угнетают костный мозг и иммунную систему и способны нарушать функций ДНК и синтез белка. Отравление парами ртути в средние века получило название «болезнь сумашедшего шляпочника». Сулема HgCI2 очень ядовита, вызывает изменение размеров, осмотическую хрупкость и снижение деформируемости эритроцитов.
Применение ртутных соединений в качестве лекарственных средств началось в глубокой древности при лечении кожных заболеваний и сифилиса. В современной медицине не используется за исключением применения в термометрах, манометрах, ртутно– кварцевых лампах и других приборах медицинского назначения.
В качестве антидота против ртутного отравления с достаточно хорошими результатами, применяют, так называемый, BAL, представляющий собой 2, 3–димеркаптопропанол. Применяют гемодиализ с такими хелатирующими агентами, как цистеин или L-ацетилпеницилламин.
Олово. По содержанию в организме человека (10-4 %) олово относится к микроэлементам. Установлено, что олово входит в состав ферментов, влияющих на рост. В организм человека олово попадает с консервированными продуктами, хранящимися в банках, покрытых слоем олова, с упаковочной фольги, с фторсодержащими зубными пастами. За сутки в организм человека поступает до 50 мг олова, в основном с пищей. Концентрируется олово в костной ткани, сердце, почках и тонком кишечнике.
В кислой среде олово растворяется, в форме соли поступает в кровь, проявляя токсическое действие. Органические соединения олова наиболее ядовиты. С избытком олова в организме может быть связано снижение аппетита, металлический привкус во рту, боли в животе, поносы, тошнота, хотя в целом олово не относится к особо токсичным металлам.
В медицинской практике находят применение различные материалы, содержащие олово, в частности пломбировочные. Так, олово входит в состав серебряной амальгамы (28 %) для изготовления пломб.
Ванадий в организм человека поступает с пищей. Ванадий входит в состав мышечной и костной ткани, сердечной мышцы, селезенки, щитовидной железы, легких, почек. Показано, что ванадий участвует в регуляции жирового и углеводного обмена. Ванадий усиливает поглощение кислорода тканями печени, оказывает влияние на уровень сахара в крови. Изучается вопрос о перспективности применения солей ванадия в лечении сахарного диабета, поскольку ванадаты обладают инсулиноподобным эффектом. Установлено, что у молодых людей присутствие ванадия сдерживает образование холестерина и снижает содержание в крови липидов, препятствует развитию патологий сердечно – сосудистой системы. Ванадий принимает участие в метаболизме тканей костей и зубов. Способствуя их минерализации ванадий препятствует развитию кариеса и остеопороза.
Суточная потребность взрослого человека не определена, но установлено, что в среднем в хорошо сбалансированном рационе населения (по данным США) ванадий составляет 20-30 мкг.
Соединения ванадия применяются в медицине в качестве стимулирующих средств при анемии, а также при лечении туберкулеза, сифилиса, ревматизма.
При избыточном поступлении может оказывать токсическое воздействие. При загрязнении окружающей среды ванадием отмечается повышенная частота заболеваний бронхо-легочной системы, верхних дыхательных путей, новообразований. Неблагоприятными экологическими факторами являются выбросы металлургических заводов при выплавке меди, спецсталей, добыча и переработка нефти, выхлопы автомобилей. Некоторые антибиотики также содержат ванадий.
|
|