
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
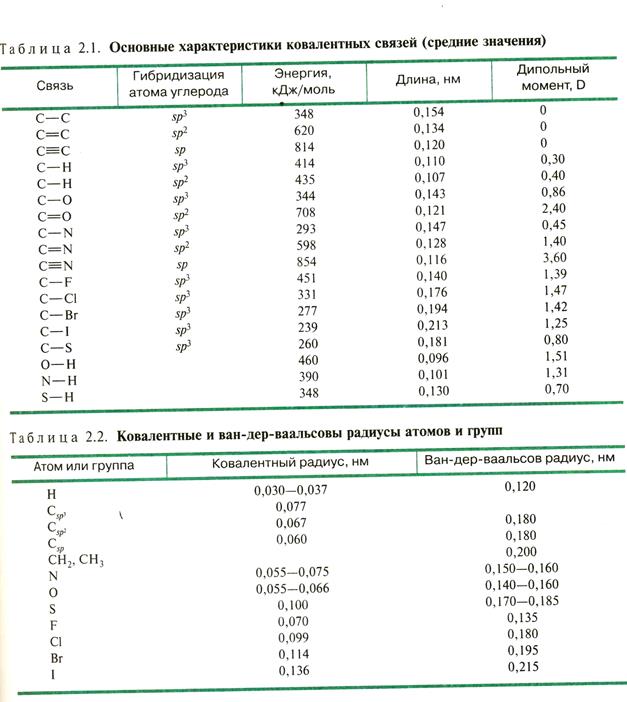
Характеристики ковалентной связи
|
|
Длина связи – расстояние (в нм) между центрами связанных атомов,
определяется методом рентгено-структурного анализа (РСА).
Ковалентный радиус атома – равен ½ длины ковалентной связи между одинаковыми атомами.
Ван-дер-ваальсов радиус – равен ½ расстояния между максимально сближенными атомами. Всегда больше ковалентного радиуса.
Валентные углы – углы между осями орбиталей (см. геометрическую конфигурацию атомных орбиталей С-атома с различной гибридизацией).
Энергия связи (кДж/моль) – энергия, которую нужно затратить для разрыва связи. Равна энергии образования связи. Является мерой прочности связи.
Может быть косвенно определена по энергии сгорания вещества.
Энергия связи уменьшается с увеличением её длины.
Кратные связи короче и прочнее ординарных, но не пропорционально; т.е.
σ -связь прочнее π -связи.
Энергия связи между одними и теми же атомами зависит от структурных особенностей, например, она уменьшается в ряду:

Полярность связи – смещение пары электронов, образующих связь, в сторону более электроотрицательного атома.
Электроотрицательность – способность атома притягивать электроны.
Электроотрицательность атомов (по Полингу):
| F | O | N | Cl | Br | I | C | S | H | Mg | Li | Na |
| 4, 0 | 3, 5 | 3, 0 | 3, 0 | 2, 8 | 2, 6 | 2, 5 | 2, 5 | 2, 1 | 1, 2 | 1, 0 | 0, 9 |
Электроотрицательность углерода:
| sp3 | sp2 | sp |
| 2, 5 | 2, 8 | 3, 1 |
Дипольный момент – мера полярности связи:
μ = q·l
q – заряды на атомах (абсолютная величина)
l – длина связи
Для многоатомных молекул μ определяется как векторная сумма дипольных моментов всех связей.
Молекулы, содержащие высокополярные связи могут быть в целом неполярны: СО2, CCl4.
Поляризуемость связи – способность к динамическому смещению электронов под действием электромагнитного поля (воздействие приближающейся активной частицы или молекул растворителя). Определяет реакционную способность связи в значительной степени.
Поляризуемость увеличивается с увеличением длины связи, например:
С-O (1) C—S (2)
у (1) стационарный диполь больше, чем у (2), но в динамических условиях реакции легко поляризуемая (2) более реакционноспособна.
Поляризуемость π -связи значительно больше, чем σ -связи.
|
|