
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Гомогенный катализ
|
|
Катализ – это изменение скорости химических реакций под влиянием веществ-катализаторов, многократно вступающих в промежуточное химическое взаимодействие с участниками реакции и восстанавливающих после каждого цикла свой химический состав. В определении катализа указывается на его химическую сущность, чем проводится различие между явлением катализа и изменением скорости химического процесса под влиянием, например, физических параметров. Особо подчеркивается стехиометрические неучастие катализатора в реакции, т.е. он не расходуется в процессе катализа. Из этого не следует, что в ходе реакции не происходит никаких изменений, поэтому важно отметить, что возможные изменения представляют собой побочные явления, не связанные с его каталитическим действием.
Причина каталитического действия различных веществ заключается в изменении механизма реакции в присутствии катализатора, т.е. возникновении нового или нескольких протекающих быстрых путей реакции.
Различают положительный и отрицательный катализ: в первом случае скорость реакции в присутствии катализатора увеличивается, во втором − уменьшается. При положительном катализе промежуточное химическое взаимодействие катализатора с исходными веществами приводит к благоприятному, энергетически доступному пути реакции, при отрицательном катализе (ингибировании) такое взаимодействие оставляет менее доступные реакционные пути, что вызывает уменьшение скорости реакции или даже ее прекращение.
Катализ – явление специфическое, поэтому каталитическую активность вещества можно оценивать только по отношению к конкретной реакции, хотя ряд катализаторов проявляет активность к группам реакций, например, катализаторы на основе  ускоряют реакции дегидрирования спиртов, крекинга углеводородов.
ускоряют реакции дегидрирования спиртов, крекинга углеводородов.
Состав и химическое строение катализаторов очень разнообразны. Катализатор может быть индивидуальным веществом (металлы, активированный уголь), соединением (оксид, соль), комплексом металла с органическими лигандами или сложным соединением белковой природы, например, ферментами.
В гомогенном катализе, когда реагенты и катализатор находятся в одной фазе, даже очень малых количеств катализатора (от 10− 13 М) достаточно для ускорения превращения большого количества реагентов в продукты, так как катализатор может использоваться многократно. Экспериментально установлено, что скорость гомогенной химической реакции пропорциональна концентрации катализатора. Этот факт является прямым подтверждением того, что катализатор действительно участвует в реакции, образуя неустойчивые промежуточные соединения, и определяет ее течение по другому, чем в его отсутствие, направлению.
Эффективность катализаторов оценивается по различным свойствам − активности, избирательности (селективности) и др. Основные положения теории промежуточных соединений заключаются в следующем:
1. Катализатор образует с исходным веществом лабильное (неустойчивое) промежуточное соединение.
2. Образование промежуточного соединения протекает обратимо и относительно быстро.
3. Неустойчивое промежуточное соединение относительно медленно претерпевает дальнейшие превращения в направлении образования конечного продукта и выделения катализатора.
4. Общая скорость каталитической реакции пропорциональна концентрации промежуточного соединения, но не реагента.
5. Один и тот же катализатор может взаимодействовать с реагентом, образуя одновременно несколько промежуточных соединений.
Все каталитические реакции характеризуются теми же термодинамическими величинами ( ), не зависящими от присутствия катализатора, что и некаталитические. Если реакция в прямом направлении термодинамически невозможна (
), не зависящими от присутствия катализатора, что и некаталитические. Если реакция в прямом направлении термодинамически невозможна (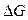 > 0), то введение катализатора в реакционную систему не приводит к ее протеканию, но может ускорить обратную реакцию. Если реакция возможна (
> 0), то введение катализатора в реакционную систему не приводит к ее протеканию, но может ускорить обратную реакцию. Если реакция возможна (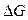 < 0) и приводит к состоянию равновесия, присутствие катализатора позволяет быстрее достичь состояния равновесия. При этом катализатор одинаково ускоряет скорости прямой и обратной реакций, но не смещает положение равновесия (это следует из выражения стандартного химического сродства:
< 0) и приводит к состоянию равновесия, присутствие катализатора позволяет быстрее достичь состояния равновесия. При этом катализатор одинаково ускоряет скорости прямой и обратной реакций, но не смещает положение равновесия (это следует из выражения стандартного химического сродства:  , где
, где 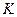 - термодинамическая константа равновесия).
- термодинамическая константа равновесия).
Для ряда изученных реакций установлено, что энергия активации существенно меньше суммы энергий разрываемых связей за счет компенсации энергией, выделяемой при образовании новых связей. Для характеристики способности веществ к вступлению в реакцию в теории катализа используется понятие степени компенсации 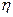 , которое определяется соотношением
, которое определяется соотношением
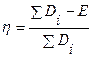 ,
,
где  − энергия активации;
− энергия активации;  − сумма энергий разрываемых связей. При
− сумма энергий разрываемых связей. При  ,
,  , т.е. компенсации нет; при
, т.е. компенсации нет; при 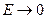 ,
,  , т.е. степень компенсации стремится к 100%. Так, для реакций с участием радикалов степень компенсации может превышать 95%, а для реакций с насыщенными молекулами составляет лишь около 70%.
, т.е. степень компенсации стремится к 100%. Так, для реакций с участием радикалов степень компенсации может превышать 95%, а для реакций с насыщенными молекулами составляет лишь около 70%.
Ускоряющее воздействие катализатора на химический процесс связано с преодолением энергетических барьеров и с регулированием пути химического превращения, благодаря тому, что катализатор, взаимодействуя с исходными реагирующими веществами и непосредственно участвуя в образовании активированного комплекса, повышает степень компенсации, тем самым уменьшает величину энергетического барьера – энергии активации и увеличивает скорость химической реакции.
Каталитическое воздействие на реакционный процесс может осуществляться в различных формах:
I - без нарушения равновесного распределения энергии в системе, т.е. при соблюдении закона Максвелла-Больцмана, по которому вероятность состояния с энергией, большей или равной  , пропорциональна множителю
, пропорциональна множителю 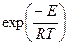 и быстро убывает с увеличением энергии. Поэтому действие катализатора сводится к тому, что он открывает реакционный путь с наименьшей высотой активационного барьера и обеспечивает наиболее вероятное протекание химической реакции;
и быстро убывает с увеличением энергии. Поэтому действие катализатора сводится к тому, что он открывает реакционный путь с наименьшей высотой активационного барьера и обеспечивает наиболее вероятное протекание химической реакции;
II - нарушение равновесного распределения энергии, обусловленное существенным изменением свободной энергии реакции (характерно для цепного механизма). При этом образуются частицы, способные аккумулировать энергию реакции, которую можно использовать для разветвления цепи;
III - ускорение первичного образования активных частиц.
|
|