
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Диоксид титана
|
|
Диоксид титана (двуокись титана) TiO2 полиморфен, он кристаллизуется в двухсингониях: брукит — в ромбической, рутил и анатаз — в тетрагональной, но последние различаются строением кристаллической решетки. В обоих случаях каждый атом титана находится в центре октаэдра и окружен 6 атомами кислорода. Пространственное же расположение октаэдров разное: в анатазе на каждый октаэдер приходится 4 общих ребра, в рутиле только два (рис. 9.1.1).
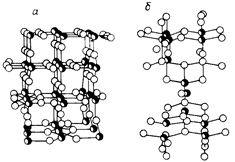
Рис. 9.1.1 Атомные модели диоксида титана рутильной (а) и анатазной (б) формы:
< - атомы титана, " - атомы кислорода.
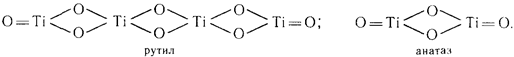
Элементарная ячейка анатаза состоит из четырех молекул, а рутила только из двух:
Благодаря более плотной упаковке ионов в кристаллах рутил превосходит анатаз по стабильности, плотности, твердости, показателю преломления, диэлектрической постоянной и обладает пониженной фотохимической активностью. При температуре 915°С анатаз переходит в рутил. Полностью этот процесс заканчивается при 950 °С, но полученный при этом рутил отличается высокой абразивностью и низкой дисперсностью. Поэтому раньше в качестве пигмента применялся только анатаз. В 1949 г. была найдена возможность управления кристаллизацией введением рутилизирующих добавок, а в последующем зародышей, что позволило снизить температуру перехода анатаза в рутил до 850 °С и получать первичные частицы размером 0, 15 - 0, 20 мкм округлой формы. Ионы Zn2+, Mg2+, Al3+, Sn2+ являются стабилизаторами рутильной формы, ионы SO42-, РО43- — анатазной. В присутствии даже малых количеств соединений фосфора переход анатаза в рутил становится невозможным. Рутилизирующие зародыши получают, обрабатывая гидратированный диоксид титана после пятой стадии промывки раствором едкого натра. При этом образуется тетратитанат натрия Na2Ti4O3, который обрабатывают соляной кислотой, и пептизируют продукт гидролиза, предварительно освобожденный от ионов SO42-. Такие зародыши вводятся перед прокаливанием.
Рутил, прокаленный при температуре около 1000 °С и содержащий примеси Fe, Cr, Ni, Mn, проявляет свойство фототропии. При освещении он становится коричневым, в темноте вновь светлеет. Это объясняется окислением примесных металлов в высшие оксиды вследствие выделения кислорода при освещении ТiO2 с деформированной решеткой.
Минимальное количество примесей, внедрение которых в кристаллическую решетку рутила вызывает изменение окраски, составляет (в г на 1 г ТiO2): 3× 10-5 Fe2O3 — желтая окраска; 1, 5× 10-6 Сr2O3 — коричневая: 3× 10-5 МnO2 — серая: 7× 10-5 V2O5 — серо-голубая. Диоксид титана, особенно его гидраты, легко адсорбирует оксиды и гидроксиды железа, которые придают желтую окраску анатазу уже при содержании 0, 009 %, рутилу - 0.003 %.
В чистом виде диоксид титана, особенно в анатазной форме, обладает высокой фотохимической активностью, что вызывает разрушение лакокрасочной пленки («меление») и выцветание органических пигментов. Закрытие активных центров поверхности частиц диоксида титана гидроксидами Al, Si, Zn резко уменьшает фотохимическую активность. Такой модифицированный рутильный диоксид титана обладает незначительной фотохимической активностью и пригоден для атмосферостойких ответственных эмалей для автомашин и сельскохозяйственной техники.
Диоксид титана химически инертнен, нерастворим в слабых кислотам и щелочах и органических растворителях. Не ядовит, ПДК в воздухе рабочих зон 10 мг/м3 Диоксид титана может применяться со всеми видами пленкообразователей и растворителей. Пригоден для водоэмульсионных, воднодисперсионных и порошковых красок. Пигментный диоксид титана широко используется для окрашивания в массе изделий из резины, пластмасс, линолеума, бумаги и химических волокон. Лакокрасочная промышленность потребляет 63 - 65 % всего вырабатываемого пигментного диоксида титана, промышленность пластмасс 12 %, бумажная промышленность 14 %. Помимо пигментного диоксида титана, содержащего 82 - 95 % (масс.) TiO2, вырабатывается диоксид титана для твердых сплавов, стекол, керамики с более высоким содержанием TiО2. Мировое производство пигментного диоксида титана в 1980 г. составило 2, 1 млн. т, из них более 75 % рутильной формы.
Сырье, для получения диоксида титана. Для переработки в пигментный диоксид титана используются минералы: природный рутил, содержащий 92 - 95 % (масс.) TiO2 и примесь Fe2О3, придающую ему красный цвет (рутил красный); ильменит FeO× TiO2 или измененный ильменит— арканзит Fe2О3× 3TiO2; титаномагнетиты, состоящие из зерен ильменита и магнетита и содержащие 8 - 12 % (масс.) TiO2.
В чистом виде титансодержащие минералы встречаются редко. Для освобождения от примесей других минералов и пустой породы измельченные руды подвергают магнитному и другим видам обогащения и получают концентраты. Ниже приведен типовой химический состав титаномагнетитовых концентратов, % (масс.):
| TiO2 | 40 - 52 |
| FeO | 26 - 36 |
| Fe2O3 | 10 - 22 |
| SiO2 | 1 - 3 |
| Al2O3 | 0, 5 - 3 |
| CaO | 0, 6 - 2 |
| MgO | 0, 6 - 3 |
| MnO2 | 0, 3 - 0, 8 |
| V2O5 | 0 - 0, 3 |
| Cr2O3 | 0, 006 - 0, 1 |
Наиболее ценным и перспективным сырьем являются титановые шлаки, получаемые при доменной и особенно электрометаллургической переработке титансодержащих руд и концентратов. Содержание ТiO2 в злаках достигает 80 - 85 % в легко растворимой в серной кислоте форме.
|
|