
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Билет 15
|
|
1). Процесс роста кристаллов. Что понимается под линейной скоростью роста кристалла? Механизм роста из сильно- и слабопересыщенных растворов и расплавов и влияние степени пересыщения на рост кристаллов. Роль дефектов кристаллической решетки при росте кристаллов.
Линейная скорость кристаллизации представляет собой скорость, с которой перемещается граница между расплавом и закристаллизовавшимся веществом в направлении перпендикулярном границе.
Кристаллизация из растворов:
Условие – наличие пересыщения. Под пересыщением в растворах понимается избыточная концентрация содержащегося в растворе вещества, П = с – с0. При некоторой степени пересыщения резко меняются оптические свойства, что говорит появлении в растворе зародышей твердых фаз, возникающих спонтанно при определенной концентрации и температуре. График зависимости концентрации от температуре: на нем кривая пересыщения и кривая насыщения. Оствальд выделил три области:
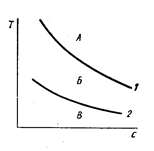
1 – кривая пересыщения; 2 – кривая насыщения.
В – область стабильного состояния растворов.
При введении в раствор вещества, идентичного растворенного, оно также растворяется, равновесие восстанавливается.
Б – метастабильная область. Спонтанное выделение твердой фазы из метастабильного раствора невозможно, но она выделяется при введении затравок.
А – пересыщенное состояние раствора.
Механизм образования зародыша: с увеличением пересыщения резко возрастает степень ассоциации частичек растворенного вещества и образуются квазикристаллы. Могут достигать размеров коллоидных частиц. Они существуют кратковременно, непрерывно распадаясь и возникая. Когда степень пересыщения достигает больших размеров, находящиеся в растворе квазикристаллы начинают выполнять функции зародышей. Связь между размером зародыша и требуемой степенью пересыщения с/с0:
Ln(c/c0) = σ μ /(ρ rRT)
Механизм роста кристалла
Согласно диффузионной теории Нернста процессы на поверхности раздела фаз протекают очень быстро, а скорость гетерогенных процессов лимитируется только диффузией. При кристаллизации поверхность кристалла покрыта тонким слоем малоподвижного раствора, в котором концентрация снижается от средней величины в растворе (с) до концентрации насыщения (с0) на самой поверхности кристалла. Этот слой и создает основное сопротивление для диффузионного перехода кристаллизующегося вещества из пересыщенного раствора па поверхность растущего кристалла. Скорость отложения вещества на гранях кристалла описывается уравнением
dm/dt = (D/δ)S(c-c0) = β S(c-c0), где m – масса вещества, перешедшего из раствора на поверхность кристалла за время t; S – поверхность растущего кристалла; D – к-т диффузии; δ -толщина пограничного слоя; β - к-т массопередачи.
Для установившегося процесса, когда масса вещества, подводимая к кристаллу диффузией, равна массе, отлагающейся на его гранях, скорость отложения вещества на гранях кристалла в общем случае можно выразить уравнением
dm/dt = (1/(δ /D + 1/ β 0))*S(c-c0),
β 0 где -к-т скорости акта кристаллизации.
Если скорость кристаллохимической стадии намного больше скорости диффузии, т. е. β 0> > β, уравнение преобразуется в обычное диффузионное уравнение. Если же общая скорость процесса кристаллизации лимитируется самим актом присоединения частиц к кристаллической решетке (β 0> > β), уравнение принимает вид^
dm/dt= β 0S(c-c0).
В настоящее время более признанной является молекулярно-кинетическая теория послойного роста кристаллов, предложенная М. Фольмером. Частица кристаллизующегося вещества вначале располагается на поверхности растущих кристаллов в виде адсорбционного слоя, при переходе в который они теряют только часть своей энергии, сохраняя значительную свободу передвижения по поверхности кристалла. Между отдельными частицами в адсорбированном слое возможны неупругие соударения, в результате которых образуются двухмерные кристаллы, присоединяющиеся к кристаллической решетке в виде нового слоя. Равновесие между адсорбированным слоем и раствором устанавливается очень быстро, вследствие чего при переходе частиц в кристаллическую решетку адсорбционный слой тотчас же восстанавливается за счет поступления в него частиц из окружающего раствора.
Для образования слоя требуется определенное конечное пересыщение раствора, при котором возникает устойчивый двухмерный зародыш, разрастающийся в дальнейшем уже по всей грани. Рост двухмерных зародышей происходит путем присоединения к ним целых периферийных рядов — одномерных зародышей. Если оседающий одномерный зародыш не в состоянии заполнить все ребро двухмерного зародыша, на нем образуется трехмерный угол, который является наиболее активным местом растущего кристалла.
Количественные расчеты показали, что для зарождения новой ступени на атомарно-гладкой поверхности требуются большие пересыщения. Между тем известно, что кристаллы растут уже при низких пресыщениях. Механизм роста в таких условиях объясняется с помощью представлений о винтовых дислокациях, генерирующих на поверхности ступень, неисчезающую в процессе роста ступень (спиральный рост кристаллов), а также с учетом экспериментальных данных о существовании таких ступенек на выращенных кристаллах. Наличие подобных ступеней на грани кристалла устраняет необходимость формирования двухмерных зародышей для его роста, и рост кристаллов может происходить при весьма малом пересыщении.
Роль дефектов:
Дислокации краевые и винтовые. Дают дополнительную ступень. Скорость роста кристаллов возрастает.
2). Диаграмма состояния системы CaO—SiО2. Характеристика бинарных соединений в этой системе: метасиликат кальция, ортосиликат кальция и их полиморфизм. Трехкальциевый силикат: области его стабильного существования. Значение системы для химии и технологии силикатов. Пути кристаллизации.
В системе СаО—SiO2 существуют следующие бинарные соединения: однокальциевый силикат (метасиликат кальция) CaO*SiO2 или CaSiO3; трехкальциевый дисиликат 3CaO*2SiO2 или Ca3Si207; двухкальциевый силикат (ортосиликат кальция) 2CaO*SiO2 или Ca2SiО4; трехкальциевый силикат 3CaO*SiO2 или Ca3Si05.
Метасиликат кальция CaO*SiO2 имеет две полиморфные модификации: низкотемпературную форму b-CaO-SiO2 (волластонит), устойчивую до температуры 1125°С, выше которой она переходит в высокотемпературную форму a-CaO-SiO2 (псевдоволластонит), плавящуюся конгруэнтно при 1544°С.
Трехкальциевый дисиликат 3CaO*2SiO2 плавится инконгруэнтно при 1464°С, разлагаясь на жидкость состава 58, 2% (мас.) СаО и 41, 8% (мас.) SiO2 и кристаллы а-2СаО*SiO2. Имеются данные о существовании двух полиморфных модификаций 3CaO*2SiO2 — ранкинита и низкотемпературной разновидности — килхоанита (на диагр не отмечены).
Двухкальциевый силикат 2CaO*SiO2 — конргуэнтно плавящееся при 2130°С соединение, обладающее сложным и до конца не изученным полиморфизмом. На рисунке приведена диаграмма состояния однокомпонентной системы 2CaO*SiO2, предложенная X. Бредигом, в соответствии с которой ортосиликат кальция существует в четырех полиморфных формах: a, a', b и g. Три из них энантиотропные, т. е. имеют температурные области стабильного существования: низкотемпературная g-форма (до 850°С), a'-форма (85О...145О°С) и высокотемпературная a-форма (145О...213О°С). Четвертая b-форма при обычном давлении не имеет температурной области стабильного существования, т. е. является метастабильной (ниже 675 °С) и монотропной по отношению к g-форме. Характер полиморфных превращений в чистых препаратах 2CaO-SiO2 можно представить следующей схемой:
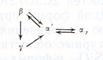
т. е. при охлаждении a'-форма сначала переходит в метастабильную b-форму, а последняя в устойчивую при низкой температуре в g-форму. Переход bgg сопровождается значительным уменьшением плотности и увеличением удельного объема (на ~13%), что приводит к саморассыпанию спеченных препаратов 2CaO*SiO2 (предотвратить переход bgg можно, например, за счет кристаллохимической стабилизации).
Еще одним соединением в системе СаО—SiO2 является трех-кальциевый силикат 3CaO-SiO2. Это соединение имеет область стабильного существования от 1250 до 2070°С. Ниже температуры 1250°С оно не стабильно и разлагается в твердом состоянии на a'-2CaO-SiO2 и СаО, а при 2070°С плавится инконгруэнтно на жидкость состава: 73, 6% (мае.) СаО и 26, 4% (мае.) SiO2 и кристаллы СаО. Трехкальциевый силикат имеет шесть мало отличающихся друг от друга по своей структуре полиморфных разновидностей, переходы между которыми относятся к полиморфным превращениям со смещением, связанным с изменениями во вторичной координационной сфере. До температуры 600°С устойчива триклинная форма ТI которая при 600... 620°С и 92О...925°С переходит соответственно в формы ТII и ТIII, являющиеся разновидностями, принадлежащими к той же триклинной системе. При 97О...98О°С триклинная форма 3CaO-SiO2 переходит в моноклинную форму MI, a при 990... 1000°С в другую разновидность моноклинной формы MII и, наконец, при 1050°С образуется тригональная (ромбоэдрическая) модификация (Тр), устойчивая вплоть до температуры инконгруэнтного плавления трехкальциевого силиката. Последовательность полиморфных превращений 3CaO-SiO2 можно изобразить схематически следующим образом:
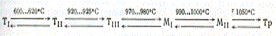
В высококремнеземистых составах этой системы наблюдается фазовое разделение однородного расплава на две несмешивающиеся жидкости, причем при температуре 1698°С в трехфазном инвариантном равновесии с кристобалитом находится жидкость, содержащая 0, 6% (маc.) СаО и 99, 4% (маc.) SiO2 и жидкость, содержащая 28, 0% (маc.) СаО и 72, 0% (маc.) SiO2.
Значение системы СаО—SiO2 определяется тем, что существующие в ней соединения являются важной составной частью многих технических продуктов — цементов, доломитовых и Других огнеупоров, некоторых видов керамики, шлаков черной металлургии и т. д. В частности, 3CaO*SiO2 в виде минерала алита представляет собой главный минерал портландцемента, (алит представляет собой твердый раствор в 3CaO*SiO2 небольшого количества примесных оксидов, прежде всего Аl2О3 и MgO), в состав портландцемента входит также b-форма 2CaO*SiO2 в виде минерала белита и т. д.
№16
1). Зависимость скорости образования центров кристаллизации и линейной скорости роста кристаллов от степени переохлаждения расплава. Кривые Таммана. Почему указанные кривые имеют максимум? Использование кривых Таммана для направленной кристаллизации с целью получения заданной микроструктуры материала.
Кристаллизация — процесс, в ходе которого из малоупорядоченной структуры расплава или стекла создается упорядоченная решетка кристалла.
Кристаллизация начинается из определенных центров, а рост кристаллов происходит путем отложения материала на первично образовавшихся субмикрокристалликах, называемых зародышами. Поэтому различают две связанных одна с другой стадии этого процесса: возникновение зародышей кристаллической фазы и их последующий рост.
Зародышеобразование представляет собой процесс возникновения областей с более дальним порядком в расположении атомов, чем это характерно в целом для расплава или стекла.
Зависимость линейной скорости роста кристаллов от степени переохлаждения расплава по Г. Тамману приведена на рис. 102. При температуре плавления скорость роста кристаллов равна нулю. При увеличении переохлаждения она увеличивается, достигает максимума и затем вновь падает до нуля, когда диффузия настолько замедляется из-за возросшей вязкости расплава, что прекращается поступление частиц кристаллизующегося вещества к фронту кристаллизации.
Количественная зависимость скорости роста кристаллов от параметров процесса кристаллизации описывается следующим уравнением:


где l — диаметр частиц вещества, переходящего из расплава в кристалл; L — число молекул, внедряющихся в кристалл.
Как видно из этой зависимости, наибольшее воздействие на скорость роста оказывает величина переохлаждения. С увеличением величины переохлаждения (rТ=Т0—Т) скорость увеличивается, однако лишь до некоторого определенного момента. Поскольку коэффициент диффузии экспоненциально уменьшается с возрастанием величины 1/T, где Т—температура раздела фаз, влияние этого параметра с некоторого момента становится преобладающим и на кривой зависимости скорости роста от степени переохлаждения возникает максимум.
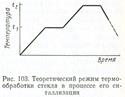
Хотя образование зародышей кристаллизации является одним из определяющих факторов при ситаллизации стекол, процессы роста кристаллов также очень важны. Поэтому режим термообработки отрабатывается для каждого стекла отдельно. На рис. 103 изображен режим идеализированной термообработки стеклокерамики по П. Макмиллану.
Первая стадия предусматривает нагревание стекла от комнатной температуры до температуры t\, при которой образуются зародыши. Скорость нагревания на этой стадии не играет большой роли и ограничения на эту скорость связаны прежде всего с недопустимостью высоких термических напряжений, способных вызвать растрескивание изделий.
Оптимальная температура зародышеобразования лежит в интервале температур, где вязкость изменяется от 10п до 1012 дПа*с и определяется экспериментально.
На последующей стадии стекло нагревают с достаточно малой регулируемой скоростью так, чтобы рост кристаллов не сопровождался деформированием изделий. Верхний предел температуры t2 кристаллизации должен быть таким, чтобы достигнуть кристаллизации с максимальной скоростью, но без деформации материала.
Весь процесс термообработки должен быть организован таким образом, чтобы образовались нужные кристаллы и в нужном количестве. Готовый продукт состоит примерно на 85% из кристаллической фазы, остаточная стеклофаза по содержанию не превышает 15%.
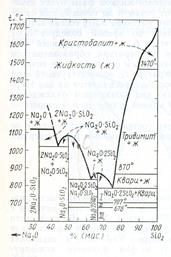
2). Диаграмма состояния системы Na2O-SiO2. Характеристика бинарных соединений в этой системе и характера их плавления. Значение системы для химии и технологии силикатов. Растворимое (жидкое) стекло: получение, свойства, применение. Пути кристаллизации составов на диаграмме этой системы.
На рисунке изображена наиболее полно изученная часть диаграммы состояния системы Na2O—SiO2 по Ф. Крачеку, начиная с составов, содержащих менее ~70% (мас.) Na2O. В этой части системы существуют следующие двойные соединения: ортосиликат натрия 2Na2O-SiO2, метасиликат натрия Na2O*SiO2 и дисиликат натрия Na2O*2SiO2. Ортосиликат натрия плавится инконгруентно при 1118°С, разлагаясь на жидкость состава 59, 3% (мас.) Na2O и 40, 7% (мас.) SiO2 и кристаллы Na2O, мета- и дисиликаты натрия плавятся конгруэнтно: первый при 1089°С и второй при 874°С. Дисиликат натрия имеет несколько полиморфных разновидностей: на диаграмме состояния они обозначены I, IIи III с температурами полиморфных превращений 707°С (InII) и 678°С (IInIII). Кроме этих полиморфных превращений Ф. Крачеком были обнаружены также полиморфные переходы дисиликата натрия при температурах 593, 573 и 549°С. Таким образом, по Ф. Крачеку, Na2O-2SiO2 имеет шесть полиморфных разновидностей.
Существуют и несколько иные данные относительно указанной части диаграммы состояния системы Na2O—SiO2. В частности, некоторые авторы относят 2Na2O-SiO2 к соединениям, плавящимся конгруэнтно при 1083°С и имеющим полиморфное превращение при 960сС. Имеются также данные о существовании других кристаллических силикатов натрия, кроме приведенных на диаграмме, в частности, 3Na2O-2SiO2 с температурой конгруэнтного плавления 1122°С и трисиликата натрия Na2O-3SiO2 с температурой плавления 750°С.
Соединения системы Na2O—SiO2 по сравнению с большинством других силикатных соединений весьма легкоплавкие. Диаграмма Na2O—SiO2 является ярким примером того, насколько сильно
может понижаться температура плавления смесей за счет образования эвтектик. Например, температура ликвидуса снижается от 1728°С для чистого SiO2 до 790 °С для эвтектики между SiO2 и Na2O-2SiO2, содержащей 73, 9% (мас.) SiO2 и 26, 1% (мас.) Na2O, т. е. почти на 1000 °С. Этим объясняется характерный для этой диаграммы резкий подъем кривой ликвидуса от эвтектики между SiO2 и Na2O*2SiO2 к температуре плавления кристобалита. Это позволяет получать в этой системе различные легкоплавкие стекла.
Система Na2O—SiO2 является частной по отношению ко многим поликомпонентным системам большого прикладного значения, например, по отношению к системам Na2O— MgO—SiO2 и Na2O—CaO— SiO2, важным для стеклоделия, к системе Na2O—Fe2O3—-SiO2, имеющей значение для объяснения процессов магматической дифференциации и т. д. Двухкомпонентная система Na2O—SiO2 имеет специальное значение для технологии изготовления натриевых растворимых (жидких) стекол, представляющих собой стеклообразные силикаты натрия переменного состава с общей формулой mNa20*nSi02.
№17
1). Кинетика твердофазовых реакций. Уравнения Яндера (в двух видах) и Гинстлинга-Броунштейна. Проведите сравнение этих уравнений: на каких стадиях твердофазовой реакции и почему каждое из этих уравнений наиболее точно описывает кинетику твердофазовой реакции.
Тамман, изучая взаимодействие между тонкими пластинками оксидов меди и вольфрама, установил, что скорость роста слоя продукта в изотермических условиях может быть выражена дифференциальным уравнением:
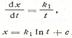
где х — толщина слоя продукта; t — время; к1 — константа, зависящая от свойств реагентов и условий процесса.
Несколько позднее В. Яндером, решившим диффузионное уравнение Фика, в предположении, что: 1) лимитирующая стадия твердофазового процесса—диффузия реагентов через слой продукта взаимодействия; 2) диффузионные слои на поверхности зерен порошкообразных реагентов являются плоскими, было получено уравнение
 или
или
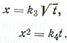
где k2 — константа, зависящая от свойств реагентов и условий процесса.

Для описания кинетики твердофазовых реакций можно использовать дифференциальное уравнение, представляющее собой комбинацию уравнений (6) и (8),
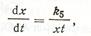
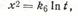 где к5 — константа, определяемая природой исходных реагентов и условиями процесса.
где к5 — константа, определяемая природой исходных реагентов и условиями процесса.
Сложность экспериментального определения толщины слоя х продукта реакции затрудняет использование уравнений (8), (10) для обработки данных по кинетике твердофазовых реакций.
В связи с этим были предприняты попытки связать толщину слоя продукта реакции и степень химического превращения одного из компонентов реакции. Первые работы в этом плане принадлежат В. Яндеру. Схема твердофазовой реакции по В. Яндеру представлена на рис. 84. Он исходил из предположения, что: 1) порошкообразный компонент А состоит из одинаковых по размеру сферических зерен с начальным радиусом г;
2) образующийся продукт реакции АВ имеет толщину, равную х, непрерывно возрастающую в ходе процесса;
3) диффузия компонента В к компоненту А через слой образовавшегося продукта лимитирует кинетику процесса в целом;
4) продукт реакции не образует твердых растворов с исходными реагентами;
5) отношение объема продукта к объему прореагировавшего материала близко к единице;
6) коэффициент диффузии частиц не изменяется во времени, а активность реагентов на границе реакционного слоя остается постоянной;
7) толщина слоя продукта изменяется во времени по параболическому закону.
Из рис. 84 следует, что объем материала V, не прореагировавшего к моменту tQ, чисто геометрическим путем может быть вычислен по уравнению
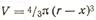 где х — толщина диффузионного слоя.
где х — толщина диффузионного слоя.
Однако объем непрореагировавшего вещества может быть выражен как
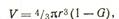 где G — доля объема материала, который уже прореагировал.
где G — доля объема материала, который уже прореагировал.
Объединяя рассмотренные уравнения и решая их относительно толщины слоя х, получим
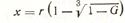 Подставляя выражение (12) в уравнения (7), (9), (11), получаем кинетические соотношения, связывающие степень протекания реакций со временем процесса:
Подставляя выражение (12) в уравнения (7), (9), (11), получаем кинетические соотношения, связывающие степень протекания реакций со временем процесса:  Уравнение (13) принято называть уравнением Яндера, Его применимость для описания конкретного твердофазового процесса проверяется с помощью графиков зависимости
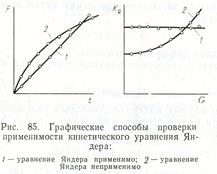
Уравнение (13) принято называть уравнением Яндера, Его применимость для описания конкретного твердофазового процесса проверяется с помощью графиков зависимости 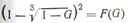 (функция Яндера) от продолжительности взаимодействия t, а также константы Яндера kя от степени превращения G (рис. 85).
(функция Яндера) от продолжительности взаимодействия t, а также константы Яндера kя от степени превращения G (рис. 85).
Линейный ход этих зависимостей свидетельствует о применимости для описания кинетики твердофазовых реакций уравнения Яндера. Согласно мнению большинства исследователей уравнение Яндера удовлетворительно описывает процесс лишь при малых степенях превращения G = 0, 2,..., 0, 4. Это является, по-видимому, следствием формального перенесения закономерностей, описывающих твердофазовые реакции в плоских слоях (параболический закон роста слоя продукта) на случай сферической диффузии.
А. М. Гинстлинг и Б. И. Броунштейн рассмотрели кинетическую модель, использовав основные предпосылки В. Яндера, за исключением предположения о параболическом законе роста слоя продукта. Эту модель иллюстрирует рис. 86. В соответствии с этой моделью скорость увеличения слоя продукта при односторонней диффузии (В-»-А) в сферическом зерне выражается уравнением
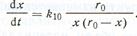
 Интегрирование этого уравнения приводит к выражению
Интегрирование этого уравнения приводит к выражению
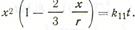 Выразив х через степень превращения G одного из компонентов, получим
Выразив х через степень превращения G одного из компонентов, получим 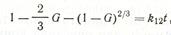 известное в литературе как уравнение Гинстлинга — Броунштейна. Следует отметить, что и уравнение Яндера, и уравнение Гинстлинга — Броунштейпа основаны на одном и том же исходном положении: скорость твердофазового процесса обратно пропорциональна толщине слоя продукта реакции. Различие в подходах состоит лишь в том, что В. Яндер рассматривает диффузию, приводящую к образованию продукта реакции на плоской границе раздела фаз, а Гинстлинг — Броунштейн решают задачу о диффузии в сферическом зерне.
известное в литературе как уравнение Гинстлинга — Броунштейна. Следует отметить, что и уравнение Яндера, и уравнение Гинстлинга — Броунштейпа основаны на одном и том же исходном положении: скорость твердофазового процесса обратно пропорциональна толщине слоя продукта реакции. Различие в подходах состоит лишь в том, что В. Яндер рассматривает диффузию, приводящую к образованию продукта реакции на плоской границе раздела фаз, а Гинстлинг — Броунштейн решают задачу о диффузии в сферическом зерне.

2). Диаграмма состояния двухкомпонентной системы с химическим соединением, образующимся или разлагающимся при изменении температуры в твердом состоянии. Признак подобного соединения на диаграмме, приведите пример такого соединения в одной из реальных двухкомпонентных диаграмм состояния, формулировка правила рычага и его применение в данной системе. Пути кристаллизации
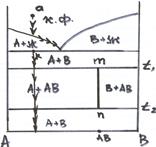
Состав а. На составе а иллюстрируется последовательность фазовых изменений при наличии в системе химического соединения, образующегося или разлагающегося при изменении температуры в твердом состоянии, т. е. ниже эвтектической температуры.
Химическое соединение AB, образующееся в этой системе между соединениями А и В (на это указывает наличие вертикали состава этого соединения m-n), устойчиво в температурном интервале t1-t2, выше которого при нагревании оно разлагается на А и В. Наоборот, при охлаждении при этого интервала это соединение образуется из компонентов А и В. Следует отметить, что при соответствующих температурах образования или разложения указанных соединений система инвариантна, т. е. эти процессы происходят при постоянной температуре.
При охлаждении жидкости состава а на кривой ликвидуса выделяются кристаллы А, состав окончательно затвердеет при эвтектической температуре tе, образуя смесь кристаллов А + В, ниже эвтектической температуры будет происходить охлаждение смеси кристаллов А и В. При температуре t1 за счет взаимодействия этих соединений образуется соединение АВ и остается избыток кристаллов А, при температуре t2 соединение АВ разложится на А и В, и смесь вновь будет состоять только из кристаллов этих соединений.
|
|