
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Билет 14. 1. Гетерогенное образование центров кристаллизации
|
|
1. Гетерогенное образование центров кристаллизации. Механизм и энергия активации процесса гетерогенного зародышеобразования и влияние на этот процесс состояния поверхности частиц посторонней фазы и степени ее смачивания жидкой фазой. Уравнение Фольмера. Катализаторы кристаллизации и требования, предъявляемы к ним. Примеры использования гетерогенного зародышеобразования в технологии силикатов.
Гетерогенное зародышеобразование имеет место, когда в ж.ф. имеются внутренние поверхности раздела (примеси, частички).
Условие: расплав должен смачивать эти твердые частички.
Если есть поверхность раздела, следовательно, не нужно тратить энергию на образование поверхности, т.е. уменьшается изменение энергии Гиббса на единицу площади этой поверхности, т.о. гетерогенное образование идет легче чем гомогенное.
Δ Gкр – энергия активации процесса гетерогенного зародышеобразования
Δ Gкр=Δ G·f(Θ)
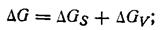
Δ G – свободная энергия активации процесса гомогенного зародышеобразования
Δ GV – изменение энергии Гиббса за счет образования более упорядоченной структуры. Δ GS – изменение энергии Гиббса за счет образования поверхности раздела фаз.
f(Θ) – функция Фольмера равная:
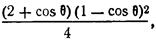
Абсолютное смачивание – капля начинает растекаться по поверхности, образую тонкую пленку, при этом краевой угол стремится к 0.
Абсолютное не смачивание – капля касается подложки в одной точке, краевой угол = 180.
При Θ =0: cos Θ =1 => Δ Gкр=0, Т.е. не нужно тратить энергии на зародышеобразования.
При Θ =180: cos Θ =-1 => Δ Gкр= Δ G, т.е. процесс идет без участия ж.ф.
При любом Θ < 180, Δ Gкр< Δ G, т.е. гетерогенное зародышеобразование идет легче, чем гомогенная, т.к. при гетерогенном не нужно затрачивать энергию на образование поверхности раздела.
Катализатор кристаллизации: примеси, частички, вводимые в ж.ф. Это м.б. любые, но наиболее эффективны, которые по составу и структуре аналогичны кристаллизующейся фазе.
Например для расплава SiO2: кварц, песок.
Имеет так же и состояние поверхности затравки, гладкая – менее эффективная, не ровная поверхность гораздо лучше действует. Затравками м.б. и ж.ф и г.ф.
Пример использование: изготовление ситаллов.
2. Трехкомпонентные диаграммы состояния с бинарными соединениями, плавящимися конгруэнтно и инкогруэнтно. Признаки подобных соединений на диаграмме. Конгруэнтные и инконгруэтные пограничные кривые: определение их характера и процессы, происходящие на этих кривых. Точка двойного подъема.
Признак бинарного соединения, плавящегося без разложения: точка состава этого соединения лежит в своем собственном поле первичной кристаллизации.
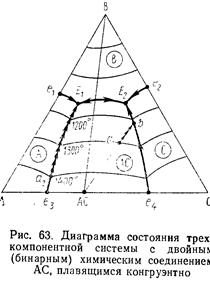
Признак соединения, плавящегося инкогруэнтно: точка состава соединения не лежит в своем поле первичной кристаллизации, а это поле примыкает к стороне треугольника, на котором лежит точка состава этого соединения.
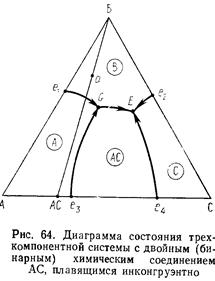
Определение характера пограничной кривой: для определения характера пограничной кривой на каком-то ее участке надо в концах этого участка провести касательные к этой кривой, если эти касательные пересекают соответственную соединительную линию, то кривая конгруэнтна, иначе – инконгруэнтна. Одна и та же кривая на различных участках может быть разной.
В точке двойного подъема при охлаждении при постоянной температуре происходит химическая реакция взаимодействия жидкой фазы (расплава) состава, этой точки с одним из трех находящихся в равновесия с жидкостью в этой точке кристаллических со единений, в результате чего реагирующее соединение полностью или частично исчезает, а два других соединения кристаллизуются из расплава. С жидкостью взаимодействует то соединение, от поля первичной кристаллизации которого отходит единственная пограничная кривая с падающей от точки двойного подъема температурой; два же других соединения, находящихся в равновесии с жидкостью вдоль указанной пограничной кривой, кристаллизуются из расплава. При нагревании процесс идет в обратном направлении.
|
|