
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Натрия бромид
|
|
1. К 0, 5 мл лекарственной формы прибавляют 0, 1 мл кислоты хлороводородной разведенной, 0, 2 мл раствора хлорамина, 1 мл хлороформа и взбалтывают. Хлороформный слой окрашивается в жёлтый цвет (бромид-ион).
2. Помещают 0, 1 мл раствора в фарфоровую чашку и выпаривают на водяной бане. К сухому остатку прибавляют 0, 1 мл раствора меди сульфата и 0, 1 мл кислоты серной концентрированной. Появляется черное окрашивание, исчезающее при добавлении 0, 2 мл воды (бромид-ион).
2NaBr + CuSO4 → CuBr2↓ + Na2SO4
3.Часть раствора на графитовой палочке вносят в бесцветное пламя. Пламя окрашивается в жёлтый цвет (натрий).
4. К 0, 1 мл лекарственной формы на предметном стекле прибавляют 0, 1мл раствора кислоты пикриновой, выпаривают досуха. Жёлтые кристаллы специфической формы рассматривают под микроскопом (натрий).
Магния сульфат
1. К 0, 5 мл лекарственной формы прибавляют по 0, 3 мл раствора аммония хлорида, натрия фосфата и 0, 2 мл раствора аммиака. Образуется белый кристаллический осадок, растворимый в кислоте уксусной разведённой (магний).
2. К 0, 5 мл лекарственной формы прибавляют 0, 3 мл раствора бария хлорида. Образуется белый осадок, нерастворимый в разведённых минеральных кислотах (сульфаты).
Глюкоза. К 0, 5 мл лекарственной формы прибавляют 1-2 мл реактива Фелинга и нагревают до кипения. Образуется кирпично-красный осадок.
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ
Вариант 1.
Натрия бромид. 1. Аргентометрический метод. 1 мл микстуры вносят в мерную колбу вместимостью 50 мл, доводят водой очищенной до метки (раствор А). 10 мл раствора А помещают в колбу для титрования прибавляют 0, 1 мл бромфенолового синего, по каплям кислоту уксусную разведённую до зеленовато-жёлтого окрашивания и титруют 0, 1 моль/л раствором серебра нитрата до фиолетового окрашивания.
1 мл 0, 1 моль/л раствора серебра нитрата соответствует 0, 01029 г натрия бромида.
Или 2. Меркуриметрический метод. К 0, 5 мл микстуры прибавляют 10 мл воды, 0, 2 мл кислоты азотной разведенной, 0, 5 мл дифенилкарбазона и титруют 0, 1 моль/л раствором ртути (II) нитрата до фиолетового окрашивания.
1 мл 0, 1 моль/л раствора ртути (II) нитрата соответствует 0, 01029 г натрия бромида.
Магния сульфат. Комплексонометрический метод. К 0, 5 мл микстуры прибавляют 20 мл воды, 5 мл аммиачного буферного раствора, 0, 05 г индикаторной смеси кислотного хром черного специального (или кислотного хром темно-синего) и титруют 0, 05 моль/л раствором трилона Б до синего окрашивания.
1 мл 0, 05 моль/л раствора трилона Б соответствует 0, 01232 г магния сульфата.
Глюкоза. Определение проводят рефрактометрически.
Содержание глюкозы в граммах (X) вычисляют по формуле.
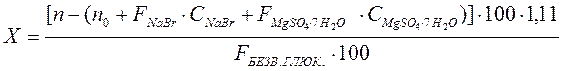
где n - показатель преломления анализируемого раствора при 200С;
n0 - показатель преломления воды при 200С;
FNaBr- фактор прироста показателя преломления раствора натрия бромида, равный 0, 001328;
СNaBr - концентрация натрия бромида в растворе, найденная аргентометрическим или меркуриметрическим методом, в %;
FМgSO4× 7Н2О- фактор прироста показателя преломления раствора магния сульфата, равный 0, 000947;
СМgSO4× 7Н2О - концентрация магния сульфата в растворе, найденная трилонометрическим методом, в %;
1, 11 - коэффициент пересчета на глюкозу, содержащую 1 молекулу кристаллизационной воды;
FБЕЗВ.ГЛЮК. - фактор прироста показателя преломления раствора безводной глюкозы, равный 0, 00142.
Вариант 2.
Магния сульфат определяют комплексонометрическим методом, как в варианте 1.
Глюкоза. Определение проводят йодиметрическим методом. 1 мл микстуры помещают в мерную колбу емкостью 50 мл и доводят водой до метки (раствор А). 5 мл раствора А помещают в колбу для титрования, прибавляют 5 мл 0, 1 моль/л раствора йода, 10 мл 0, 1 моль/л раствора натрия гидроксида и оставляют на 10 мин. По истечении указанного времени к раствору прибавляют 10 мл 0, 1 моль/л раствора кислоты серной и выделившийся йод титруют 0, 1 моль/л раствором натрия тиосульфата в присутствии раствора крахмала (до обесцвечивания).
1 мл 0, 1 моль/л раствора йода соответствует 0, 0099 г глюкозы.
Натрия бромид. Определение проводят рефрактометрическим методом.
ПРОПИСЬ 2. Кальция хлорида
Натрия бромида по 10, 0
Натрия тиосульфата 20, 0
Воды очищенной до 100, 0 мл
|
|