
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Общая характеристика. Таблица – Наиболее распространенные группы минералов подкласса «Слоистые силикаты» Подкласс Группа Слоистые силикаты Группа слюд
|
|
Таблица – Наиболее распространенные группы минералов подкласса «Слоистые силикаты»
| Подкласс | Группа |
| Слоистые силикаты | Группа слюд |
| Группа талька | |
| Группа серпентина – каолинита |
Для слоистых силикатов характерна кристаллическая структура с кристаллическими решетками (плоскими сетками) гексагонального или псевдогексагонального строения (рис. 1).
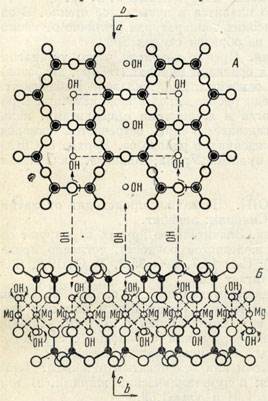
Рисунок – Гексагональная сетка связанных групп SiO4, образующих непрерывный слой - вид А. Внизу (Б) показан вид сбоку (вдоль оси а) решетки, состоящей из двух слоев групп SiO4 и заключенного между ними одного слоя Mg[OH]2. На виде Б вершины тетраэдров SiO4 в обоих слоях обращены навстречу друг другу.
Характерной химической особенностью слоистых силикатов является то, что в их составе, так же как и в группе амфиболов, всегда принимает участие гидроксил [ОН]1-нередко вместе с F1-. Из катионов распространены Mg2+ и Аl3+, которые часто изоморфно замещаются Fe2+, Ni2+, Mn2+, Li1+ совместно с Fe3+, реже Cr3+, V3+. Кроме того, во многие минералы, в структуре которых тетраэдры SiO4 частично заменены АlO4 (т.е. в алюмосиликаты) входят катионы: К1+, Na1+, Са2+, а также молекулы воды. Все катионы, а также молекулы воды располагаются между слоями кремнекислородных тетраэдров, связывая эти слои между собой.
Физические свойства слоистых силикатов, как и всех остальных минералов, обусловлены особенностями их кристаллического строения. Слоистое строение кристаллической решетки обусловливает свойство минералов рассматриваемого подкласса расщепляться на тонкие листочки. Способность к расщеплению и степень упругости этих листочков для разных групп минералов не одинакова. Это определяется прочностью (типом) химической связи между плоскими сетками, а также прочностью химических связей внутри плоских сеток. При вандерваальсовских (слабых) связях между плоскими сетками, расщепление происходит легко. Такое расщепление характерно для минералов группы талька и минералов группы слюд. Однако получаемые при расщеплении листочки могут быть и хрупки и упруги. Этот физический параметр зависит от химической связи внутри плоских сеток, т.е. от химического состава элементов, образующих плоские сетки. Например, для минералов группы талька, где связи между плоскими сетками обусловлены силами Ван-дер-Ваальса, а внутри сеток все связи компенсированы (рис. 2) – расщепление происходит легко и листочки хрупкие. По этой же причине для минералов группы талька характерна низкая твердость.

Рисунок – Кристаллическая решетка талька
В тех минералах, в которых часть ионов Si4+ заменяется ионами Аl3+ (в той же четверной координации), наблюдается существенное изменение физических свойств. Замена одного иона Si4+ на ион Аl3+ приводит к увеличению отрицательного заряда в анионном радикале на единицу. Для нейтрализации приобретенного отрицательного заряда в пространство между пакетами плоских сеток входят одновалентные катионы К1+ с большим ионным радиусам. В итоге образуются прочно связанные между собой пакеты внутри плоских сеток. Связи между плоскими сетками существенно не изменяются, т.е. в значительной степени определяются силами Ван-дер-Ваальса. Отсюда, как следствие, твердость таких минералов (типичных слюд) значительно выше, чем талька; отщепляемые тонкие листочки обладают упругостью, т. е. способностью при изгибании возвращаться в прежнее положение.
Если в анионном радикале два иона Si4+ заменены двумя ионами Аl3+, то отрицательный заряд радикала возрастает до -2. В этом случае избыточный отрицательный заряд компенсируется двухвалентными катионами, например Са2+, ионы которого (меньшие по размерам) располагаются в иных местах, нежели ионы К1+. Это приводит к увеличению прочности связи между пакетами внутри плоских сеток и существенно изменяет связь между плоскими сетками (уменьшается расстояние между плоскими сетками). Как следствие твердость таких минералов возрастает, расщепляемость затруднена, отщепляемые пластинки ломки. Некоторые авторы называют минералы этой группы хрупкими слюдами.
Приведенные примеры иллюстрируют положение о том, что физические свойства минералов обусловлены особенностями их кристаллического строения. В свою очередь особенности кристаллического строения минералов зависят от их химического состава.
|
|