
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
При разных температурах
|
|
| Т, К | ||||||
| ЭДС, мВ | 225, 5 | 217, 8 | 214, 5 | 211, 3 | 208, 1 | 206, 2 |
Представим данные таблицы графически (рис.7).

Рис.7
Из анализа рис.7 можно сделать вывод, что стандартная ЭДС данного гальванического элемента будет понижаться с повышением температуры, т.е. температурный коэффициент ЭДС будет отрицательным. Также из рис.7 следует, что зависимость стандартной ЭДС от температуры практически линейна. Для нахождения величины температурного коэффициента нам нужно найти угловой коэффициент самой зависимости.
Это можно сделать, определив тангенс угла наклона, взяв две достаточно удаленные точки на прямой M 1 и M 2 по формуле
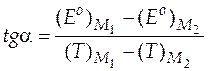 .
. 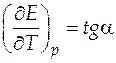 .
.
При построении рисунков на компьютере, например в Excel, можно использовать прием линеаризации зависимости, проводя линию тренда (линейную), и тогда уравнение линии тренда (на рис.7 это уравнение вверху рисунка) позволит определить угловой коэффициент зависимости. Так в указанном примере уравнение имеет вид
y = − 0, 6447 x +414, 39.
В символах реальных величин это уравнение выглядит так:
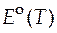 = − 0, 6447 T +414, 39.
= − 0, 6447 T +414, 39.
Температурный коэффициент ЭДС таким образом равен
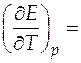 − 0, 6447 мВ/К = − 6, 447∙ 10− 4 В/К.
− 0, 6447 мВ/К = − 6, 447∙ 10− 4 В/К.
Проинтегрируем это выражение в пределах по температуре от 293 К до температуры T и получим зависимость стандартной ЭДС гальванического элемента от температуры
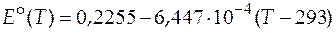 . (20)
. (20)
Найдем значения термодинамических характеристик токообразующей (итоговой) реакции в этом гальваническом элементе, т.е. стандартной мольной энергии Гиббса реакции 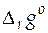 , стандартной мольной энтропии реакции
, стандартной мольной энтропии реакции  , и стандартной мольной энтальпии реакции
, и стандартной мольной энтальпии реакции 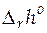 при 298 К. Сопоставим эти значения с рассчитанными из справочных таблиц термодинамических величин.
при 298 К. Сопоставим эти значения с рассчитанными из справочных таблиц термодинамических величин.
Такой гальванический элемент был рассмотрен ранее, но приведем еще раз реакции на электродах и итоговую реакцию, протекающую в этом элементе:
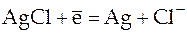 ;
;
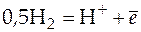 ;
; 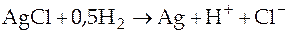 .
.
Значение стандартной ЭДС при 298 К найдем из уравнения
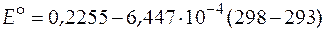 = 0, 22228 В.
= 0, 22228 В.
Значение стандартной мольной энергии Гиббса реакции при 298 К равно
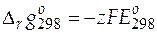 =− 1∙ 96485∙ 0, 22228 = − 21446 Дж/моль.
=− 1∙ 96485∙ 0, 22228 = − 21446 Дж/моль.
Стандартную мольную энтропию протекающей в гальваническом элементе реакции при 298 К можно рассчитать, используя значения температурного коэффициента ЭДС, который равен
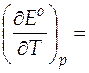 − 6, 447 ∙ 10− 4 В/К.
− 6, 447 ∙ 10− 4 В/К.
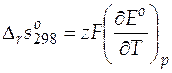 = 1∙ 96485∙ (− 6, 447∙ 10− 4) = − 62, 19 Дж/(моль∙ К).
= 1∙ 96485∙ (− 6, 447∙ 10− 4) = − 62, 19 Дж/(моль∙ К).
Стандартную мольную энтальпию реакции при 298 К находим

= 1∙ 96485∙ [298∙ (− 0, 0006447)− 0, 22228]= − 39983 Дж/моль
Для сопоставления данных, полученных методом ЭДС, с данными, рассчитанными по таблицам термодинамических величин, составим табл.3 со справочными данными, в которую внесем информацию о стандартных мольных энтальпиях и энергиях Гиббса образования и стандартных мольных энтропиях всех участников итоговой реакции.
Таблица 3
|
|