
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Общие сведения. Известно, что если металл поместить в раствор его соли, то на границе металл-раствор возникнет скачок потенциала
|
|
Известно, что если металл поместить в раствор его соли, то на границе металл-раствор возникнет скачок потенциала. Его возникновение можно упрощенно объяснить следующим образом.
Сопоставим значения энергии кристаллической решетки  и энергии сольватации или в случае водных растворов - энергии гидратации
и энергии сольватации или в случае водных растворов - энергии гидратации 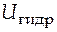 . Если
. Если  >
> 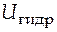 , то ионы Mez+ из раствора могут переходить на поверхность металла. Она при этом приобретает избыточный положительный заряд. Если
, то ионы Mez+ из раствора могут переходить на поверхность металла. Она при этом приобретает избыточный положительный заряд. Если  <
< 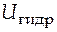 , то ионы Mez+ с поверхностного слоя металла переходят в раствор и поверхность приобретает при этом отрицательный заряд.
, то ионы Mez+ с поверхностного слоя металла переходят в раствор и поверхность приобретает при этом отрицательный заряд.
Гальваническим элементом называется система, в которой за счет протекающей в ней химических процессов генерируется электрическая энергия.
Гальванический элемент (ГЭ) является комбинацией электронных и ионных проводников. Рассмотрим в качестве примера элемент Даниэля-Якоби, состоящий из цинкового и медного электродов, опущенных соответственно в растворы сульфатов цинка и меди, разделенных пористой диафрагмой, предотвращающей смешение растворов (рис.1).
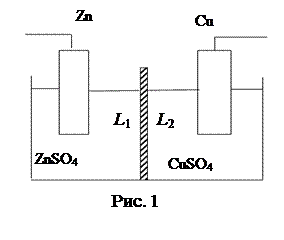 Разность потенциалов в гальваническом элементе возникает за счет самопроизвольно протекающей окислительно-восстановительной химической реакции, в которой процессы окисления и восстановления пространственно разделены.
Разность потенциалов в гальваническом элементе возникает за счет самопроизвольно протекающей окислительно-восстановительной химической реакции, в которой процессы окисления и восстановления пространственно разделены.
Согласно рекомендации IUPAC на левом электроде следует записывать реакцию окисления, а на правом - реакцию восстановления, при этом левый электрод заряжается отрицательно, а правый положительно. Учитывая то, что число электронов, участвующих в реакции восстановления, должно быть равно числу электронов, участвующих в реакции окисления, суммарную электродную реакцию находят путем линейной комбинации реакций окисления и восстановления с учетом соответствующих коэффициентов (коэффициентов линейной комбинации).
Следуя вышеизложенному, электродные реакции, протекающие в рассматриваемом в качестве примера элементе Даниэля-Якоби, можно записать
(-)  (1)
(1)
(+) 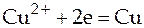 (2)
(2)
Результирующая реакция, протекающая в гальваническом элементе, находится путем линейной комбинации реакций (1) и (2):
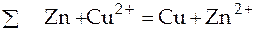 .
.
Коэффициенты линейной комбинации реакций (1) и (2) для данного гальванического элемента равны единице. В случае другого гальванического элемента, например элемента, составленного из цинкового и серебряного электродов, опущенных в водные растворы своих азотнокислых солей, коэффициенты линейной комбинации электродных реакций будут иметь иные значения:
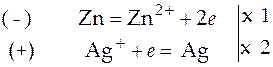
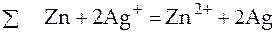 .
.
Число электронов (z), которое проходит через электрохимическую цепь, когда суммарная электронная реакция совершает один пробег, находится как наименьшее общее кратное и для рассмотренной выше реакции z =2.
Вернувшись к элементу Даниэля-Якоби, отметим, что цинковый электрод заряжается отрицательно, а медный - положительно. При замыкании цепи происходит перемещение электронов от цинка к меди в проводнике, соединяющем электроды. Одновременно через пористую диафрагму будет происходить диффузия ионов 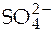 :
:
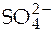 (
( ) ®
) ® 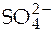 (
( 1)
1)
 Условно схема электрохимической цепи записывается следующим образом:
Условно схема электрохимической цепи записывается следующим образом:
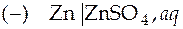
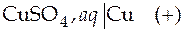
Вертикальной сплошной чертой обозначается граница между металлом и раствором; пунктирной чертой обозначается граница между двумя электролитами. Элемент называется правильно разомкнутым, если на обоих концах его находится один и тот же проводник:

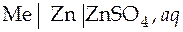
 .
.
Если существует равновесие на каждой фазовой границе, а разность потенциалов на концах правильно разомкнутой цепи скомпенсирована разностью потенциалов от внешнего источника тока, то такая электрохимическая цепь равновесна. Напряжение в электрохимической цепи при этом достигает максимального значения. Его называют электродвижущей силой (Е).
 Рассмотрим в общем виде гальванический элемент
Рассмотрим в общем виде гальванический элемент

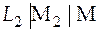 . (3)
. (3)
Электродвижущая сила (ЭДС) гальванического элемента равна сумме скачков потенциалов (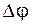 ) на границах раздела фаз и для ГЭ, представленного схемой (3) она равна:
) на границах раздела фаз и для ГЭ, представленного схемой (3) она равна:
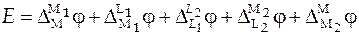
где  − скачки потенциала на границе между металлами M и M1, М и M2; это контактная разность потенциалов;
− скачки потенциала на границе между металлами M и M1, М и M2; это контактная разность потенциалов;
 − скачки потенциала на границе металл- раствор; это так называемые Гальвани-потенциалы;
− скачки потенциала на границе металл- раствор; это так называемые Гальвани-потенциалы;
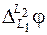 - скачок потенциалов на границе между двумя растворами или диффузионная разность потенциалов.
- скачок потенциалов на границе между двумя растворами или диффузионная разность потенциалов.
Обычно стараются проводить эксперимент таким образом, чтобы исключить (или существенно минимизировать) диффузионную разность потенциалов. На рис. 2. приведен гальванический элемент с электролитическим ключом. Электролитический ключ, заполненный KCl, позволяет исключить (элиминировать) диффузионную разность потенциалов, т.е. в этом случае  = 0.
= 0.
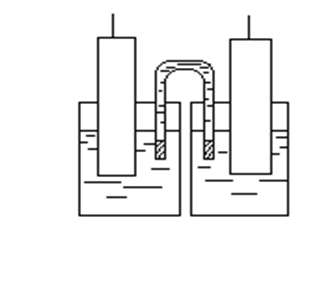 Солевой мост представляет собой изогнутую трубку, заполненную насыщенным раствором KCl (или KNO3, NH4NO3). Высокая концентрация KCl приводит к тому, что диффузионный потенциал на границе между солевым мостиком и раствором определяется диффузией ионов калия и хлоридных ионов. Уменьшение диффузионного потенциала объясняется тем, что числа переноса и подвижности ионов указанных солей KCl, KNO3, NH4NO3 близки.
Солевой мост представляет собой изогнутую трубку, заполненную насыщенным раствором KCl (или KNO3, NH4NO3). Высокая концентрация KCl приводит к тому, что диффузионный потенциал на границе между солевым мостиком и раствором определяется диффузией ионов калия и хлоридных ионов. Уменьшение диффузионного потенциала объясняется тем, что числа переноса и подвижности ионов указанных солей KCl, KNO3, NH4NO3 близки.
Условно гальванический элемент с уменьшенным с помощью солевого моста диффузионным потенциалом изображается схемой

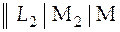 . (4)
. (4)
В этом случае ЭДС элемента представляет собой сумму следующих скачков потенциалов:
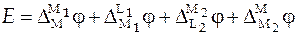 . (5)
. (5)
По закону Вольта

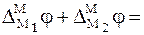
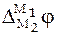
что позволяет уравнение (5) записать в виде суммы трех скачков потенциалов:
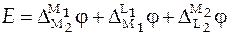 . (6)
. (6)
Из уравнения (6) следует, что материал соединительных проводов не влияет на величину ЭДС.
Экспериментально можно определить только ЭДС цепи, т.е. разность электродных потенциалов, но измерить абсолютное значение электродного потенциала для каждого электрода невозможно. Задача практического определения электродного потенциала была решена с использованием условной шкалы, в которой потенциалы электродов сопоставляют с потенциалом условно выбранного электрода сравнения. Для водных растворов наибольшее распространение получила условная водородная шкала. Современное определение электродного потенциала − это ЭДС электрохимического элемента, составленного из исследуемого и стандартного водородного электродов, при условии, что диффузионный потенциал, возникающий на границе двух растворов, устранен.
Электродвижущую силу любого гальванического элемента можно рассчитать, используя электродные потенциалы электродов, из которых этот элемент составлен. Например, рассчитаем ЭДС гальванического элемента, представленного схемой (4).
Запишем для этого два дополнительных гальванических элемента I и II, ЭДС которых равны условным электродным потенциалам электродов. Они будут составлены следующим образом:
I. 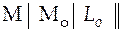
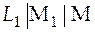 ,
,
Стандартный электрод
II. 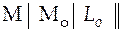
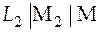 .
.
Стандартный электрод
Слева будет расположен условный электрод сравнения 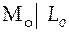 , а справа в гальваническом элементе I будет расположен электрод, который в исследуемом гальваническом элементе был слева, а в гальваническом элементе II − электрод, который в исследуемом ГЭ был справа.
, а справа в гальваническом элементе I будет расположен электрод, который в исследуемом гальваническом элементе был слева, а в гальваническом элементе II − электрод, который в исследуемом ГЭ был справа.
Выразим электродвижущие силы гальванических элементов I и II через скачки потенциалов:


Найдем разность между ЭДС этих дополнительных ГЭ:
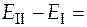
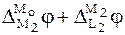
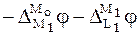
С учетом того, что  , а
, а 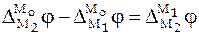 ,
,
получим
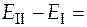
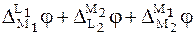 . (7)
. (7)
Из сравнения уравнений (6) и (7) следует, что
 .
.
 Следовательно, ЭДС любого ГЭ равна разности условных электродных потенциалов правого и левого электродов.
Следовательно, ЭДС любого ГЭ равна разности условных электродных потенциалов правого и левого электродов.
В качестве условного электрода сравнения используют водородный электрод, изображенный на рис. 3 (1 - сосуд; 2- испытуемый раствор; 3 - платиновый электрод; 4 - стеклянный тубус с колоколом; 5 - токоподвод).
Рис. 3
Схематично водородный электрод изображают так: 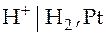 . Платина, покрытая платиновой чернью, служит сорбентом водорода и катализатором реакции, протекающей на электроде. Эту реакцию можно записать тоже двояко:
. Платина, покрытая платиновой чернью, служит сорбентом водорода и катализатором реакции, протекающей на электроде. Эту реакцию можно записать тоже двояко:
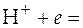 ½
½ 
Если 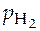 = 1 атм, а активность
= 1 атм, а активность  = 1 моль/л, то этот электрод называется нормальным (стандартным) водородным электродом.
= 1 моль/л, то этот электрод называется нормальным (стандартным) водородным электродом.
Запишем теперь схему гальванического элемента, ЭДС которого равна электродному потенциалу электрода Mez+| Me.
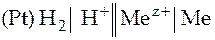
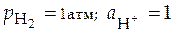
В элементе протекает реакция
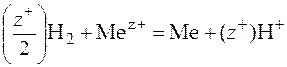 .
.
При условии, что  1 атм; а активность ионов водорода равна единице (
1 атм; а активность ионов водорода равна единице ( 1) электродвижущая сила элемента называется электродным потенциалом исследуемого электрода в водородной шкале и обозначается
1) электродвижущая сила элемента называется электродным потенциалом исследуемого электрода в водородной шкале и обозначается  . Если активность ионов металла тоже равна единице
. Если активность ионов металла тоже равна единице 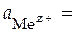 1, то ЭДС элемента будет называться стандартным электродным потенциалом исследуемого электрода в водородной шкале и обозначаться
1, то ЭДС элемента будет называться стандартным электродным потенциалом исследуемого электрода в водородной шкале и обозначаться 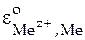 .
.
В литературе наблюдается многообразие форм записи как электродных потенциалов, так и самих электродов и гальванических элементов. Так условные электродные потенциалы могут обозначаться 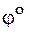 [1],
[1], 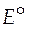 [3] и
[3] и  [5, 6]. В нижнем правом индексе символа, обозначающего условный стандартный электродный потенциал, приводится информация об окисленной и восстановленной формах веществ. Она в разных учебниках может быть записана по-разному: например для цинкового электрода:
[5, 6]. В нижнем правом индексе символа, обозначающего условный стандартный электродный потенциал, приводится информация об окисленной и восстановленной формах веществ. Она в разных учебниках может быть записана по-разному: например для цинкового электрода:  ;
; 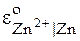 ;
;  ;
; 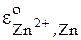 . В данной работе будет использовано такое обозначение
. В данной работе будет использовано такое обозначение 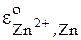 .
.
Материал о классификации электродов приведен во многих учебных пособиях и мы не будем на нем останавливаться подробно. Но следует отметить, что в разных учебниках наблюдается различие в формах записи электродов. Поэтому при написании теоретической части курсовой работы нужно не просто найти подходящий материал, но и изложить его в терминах и обозначениях единых по всей курсовой работе − в таких, которые используются в данных методических указаниях.
Опираясь на классические, рекомендованные министерством образования учебники [1, 2], будем обозначать электроды следующим образом:
электрод первого рода:  ;
;
электрод второго рода: 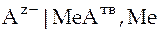 ;
;
газовый электрод: 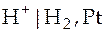 ;
;
окислительно-восстановительный электрод:
простой: Ox, Red | Pt; сложный: Ox, Red, H+| Pt.
Стандартные условные электродные потенциалы при 298 К приводятся в справочниках. Все необходимые для расчетов курсовой работы электродные потенциалы приведены в Приложении.
|
|