
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Всех форм обучения
|
|
ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ
Методические указания
К выполнению лабораторной работы
По курсу «Химия» для технических направлений
всех форм обучения
Одобрено
редакционно-издательским советом
Балаковского института техники, технологии и управления
Балаково
Цель работы: изучить принцип работы гальванических элементов.
ОСНОВНЫЕ ПОНЯТИЯ
Гальванические элементы – химические источники (генераторы) электрической энергии. Они представляют собой системы, состоящие из двух электродов (проводников 1 рода), погруженных в растворы электролитов (проводников П рода).
Электрическая энергия в гальванических элементах получается за счет окислительно-восстановительного процесса при условии раздельного проведения реакции окисления на одном электроде и реакции восстановления на другом. Например, при погружении цинка в раствор сульфата меди цинк окисляется, а медь восстанавливается:
Zn + CuSO4 = Cu + ZnSO4 (1)
Zn0 + Cu2+ = Cu0 + Zn2+
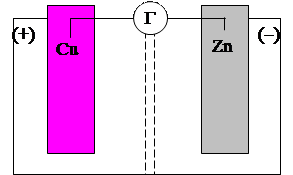
Можно провести эту реакцию так, чтобы процессы окисления и восстановления были пространственно разделены; тогда переход электронов от восстановителя к окислителю будет происходить не непосредственно, а через электрическую цепь. На рис.1 видно, что электроды погружены в растворы солей и находятся в состоянии электрического равновесия с растворами. Цинк, как более активный металл, посылает в раствор больше ионов, чем медь, в результате чего цинковый электрод за счет остающихся на нем электронов заряжается более отрицательно, чем медный. Растворы разделены перегородкой, проницаемой только для ионов, находящихся в электрическом поле.
Если электроды соединить между собой проводником (медной проволокой), то электроны с цинкового электрода, где их больше, будут по внешней цепи перетекать на медный. Возникает непрерывный поток электронов - электрический ток. В результате ухода электронов с цинкового электрода Zn цинк начинает переходить в раствор в виде ионов, восполняя
убыль электронов и стремясь тем самым восстановить равновесие.
 |
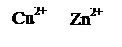 |
Рис.1. Схема гальванического элемента
Таким образом, на цинковом электроде идет процесс окисления:
Zn0 – 2e → Zn2+ (анодный процесс)
В то же, время вследствие притока электронов, медный электрод заряжается более отрицательно, чем при равновесном состоянии. Ионы меди, находящиеся в растворе, подходя к электроду, принимают от него по два электрона и в виде атомов осаждаются на поверхности. На медном электроде происходит процесс восстановления:
Cu2+ + 2e → Cu0 (катодный процесс)
Электрод, на котором протекает окисление, называется анодом. Электрод, на котором протекает восстановление, называется катодом.
Ниже приводятся реакции, протекающие на электродах.
Zn + SO42- → Zn2+ + SO42- + 2e (анод) Cu2+ + 2e + SO42- → Cu + SO42- (катод)
Zn + CuSO4 → Cu + ZnSO4 (суммарная реакция)
Так как в целом система всегда электронейтральна, символ электронов в суммарной реакции отсутствует.
В правом стакане образуется недостаток анионов SO42-, а в левом- избыток. Поэтому во внутренней цепи работающего гальванического элемента будет наблюдаться перемещение ионов SO42- из левого стакана в правый через перегородку.
Рассмотренный гальванический элемент при записи изображается схемой: (-)Zn / ZnSO4 | | CuSO4 / Cu (+) или в ионном виде:
(-)Zn / Zn2+ | | Cu2+/Cu, где одиночные вертикальные линии означают границу металл-раствор электролита, а двойная – раствор-раствор.
Гальванические элементы характеризуются электродвижущей силой, которая может быть рассчитана как разность потенциалов электродов, составляющих гальванический элемент:
ЭДС= Еок. – Евосст (2)
где ЭДС- электродвижущая сила;
Еок. – электродный потенциал электрода, имеющего большую
алгебраическую величину, то есть менее активного элемента;
Евосст - электродный потенциал электрода, имеющего меньшую
алгебраическую величину, то есть более активного металла.
Электродный потенциал металла, опущенного в раствор собственной соли при комнатной температуре, зависит от концентрации одноименных ионов и определяется по формуле Нернста:
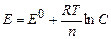 ,
,  (3)
(3) 
где E0 – нормальный (стандартный) потенциал, В;
R – универсальная газовая постоянная, равная 8, 31Дж(моль.К);
F – число Фарадея;
Т - абсолютная температура, К;
С - концентрация ионов металла в растворе, г-мольл.
Подставляя значения R, F, стандартное температуры Т=2980К и множитель перехода от натуральных логарифмов (2, 303)к десятичным, получают удобную для применения формулу:
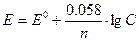 (4)
(4)
Нормальным или температурным потенциалом называется потенциал растворения металла, погруженного в раствор собственного иона с концентрацией ионов металла, равной единице (1г-ион/л), измеренный по сравнению с нормальным электродом, потенциал которого условно принимают равным нулю, при температуре t=250С и давлении P=1 атм.
Величины стандартных потенциалов позволяют решать вопрос о направлении возможного протекания окислительно-восстановительных реакций.
При работе гальванического элемента электрохимическая система с более высоким значением электродного потенциала выступает в качестве окислителя, а с более низким - восстановителя.
Гальванические элементы могут быть составлены из двух совершенно одинаковых по природе электродов, погруженных в растворы одного и того же электролита, но различной концентрации. Такие элементы называются концентрационными.
В концентрационных цепях для обоих электродов величины n и E0 одинаковы, поэтому для расчета ЭДС такого элемента можно использовать
формулу:
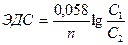 (5)
(5)
где С1– концентрация электролита в более концентрированном растворе;
С2 - концентрация электролита в более разбавленном растворе.
Практического значения как источников электрической энергии они
не имеют; их ЭДС даже при огромной разности концентраций не превосходит нескольких десятков милливольт.
Разность между фактическим потенциалом катода и теоретическим электродным потенциалом E называется перенапряжением на катоде. Величина перенапряжения зависит от природы катода, состояния его поверхности, температуры и плотности тока.
ТРЕБОВАНИЯ БЕЗОПАСНОСТИ ТРУДА
1.Опыты с неприятно пахнущими и ядовитыми веществами проводятся обязательно в вытяжном шкафу.
2. При распознавании выделяющегося газа по запаху следует направлять струю движениями руки от сосуда к себе.
3. Выполняя опыт, необходимо следить за тем, чтобы реактивы не попали на лицо, одежду и рядом стоящего товарища.
4. При нагревании жидкости, особенно кислот и щелочей, держать пробирку отверстием в сторону от себя.
5. При разбавлении серной кислоты нельзя приливать воду к кислоте, необходимо вливать кислоту осторожно, небольшими порциями в холодную воду, перемешивая раствор.
6. По окончании работы необходимо тщательно вымыть руки.
7. Отработанные растворы кислот и щелочей рекомендуется сливать в специально приготовленную посуду.
8. Все склянки с реактивами необходимо закрывать соответствующими пробками.
9. Оставшиеся после работы реактивы не следует выливать или высыпать в реактивные склянки (во избежание загрязнения).
Порядок выполнения работы
Задание 1
ИССЛЕДОВАНИЕ АКТИВНОСТИ МЕТАЛЛОВ
Приборы и реактивы: металлы магний и цинк; 0, 1 н раствор CuSO4; колбы.
Кусочек гранулированного цинка опустите в 0, 1 н раствор сульфата меди. Оставьте стоять спокойно в штативе и наблюдайте происходящее. Составьте уравнение реакции. Сделайте вывод- какой металл можно взять в качестве анода и какой - в качестве катода для следующего опыта.
Задание 2
ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ
Приборы и реактивы: р-р хлорида калия (концентрированный), растворы солей, 1 р; стаканы.
В один стакан налейте до ¾ объема 1н раствора соли металла, являющегося анодом, а в другой- такой же объем 1 н раствора соли металла, являющегося катодом. Оба стакана соедините V-образной трубкой, заполненной концентрированным раствором KCl. Концы трубки закройте плотными кусочками ваты и опустите в оба стакана так, чтобы они погрузились в приготовленные растворы. В один стакан опустите пластинку металл- анод, в другую- пластинку металл- катод; смонтируйте гальванический элемент с измерительным прибором. Замкните цепь и отметьте по гальванометру направление тока.
Составьте схему гальванического элемента.
Напишите электронные уравнения реакций, протекающих на аноде и катоде данного гальванического элемента.
Задание 3
ОПРЕДЕЛЕНИЕ АНОДА ИЗ УКАЗАННОГО
НАБОРА ПЛАСТИНОК
Приборы И реактивы: Zn, Cu, Fe, Al –металлы, сульфат цинка, ZnSO4 1 н, сульфат медиCuSO4 1 н, сульфат алюминия Al2(SO4)3 1 н.
Составьте гальванические пары:
Zn / ZnSO4 | | FeSO4 / Fe
Zn / ZnSO4 | | CuSO4/ Cu
Al/Al2(SO4)3 || ZnSO4 /Zn
Из указанного набора пластинок и растворов солей этих металлов соберите гальванический элемент, в котором цинк являлся- бы катодом (опыт 2).
Составьте электронные уравнения реакций, протекающих на аноде и катоде собранного гальванического элемента.
Напишите окислительно-восстановительную реакцию, которая лежит в основе работы данного гальванического элемента.
ОФОРМЛЕНИЕ ЛАБОРАТОРНОГО ЖУРНАЛА
Лабораторный журнал заполняется по следующей схеме:
1. Дата выполнения работы.
2. Название лабораторной работы и ее номер.
3. Название опыта и его цель.
4. Наблюдения, уравнения реакций, схема прибора.
5. Выводы.
6. Контрольные вопросы и задачи по теме.
КОНТРОЛЬНЫЕ ЗАДАНИЯ
1.Какие из указанных ниже реакций возможны? Написать уравнения реакций в молекулярном виде, составить для них электронные уравнения:
· Zn(NO3)2 + Cu →
· Zn(NO3)2 + Mg →
· FeSO4 +Zn →
· AlCl3 + Ag→
2. Составьте схемы гальванических элементов для определения нормальных электродных потенциалов Al/Al3+, Cu/Cu2+ в паре с нормальным водородным электродом.
3.Вычислите ЭДС гальванического элемента
Zn/ZnSO4(1M)| | CuSO4(4 M)
Какие химические процессы протекают при работе этого элемента?
4. Химически чистый цинк почти не реагирует с соляной кислотой. При добавлении к кислоте нитрата свинца происходит частичное выделение водорода. Объясните эти явления. Составьте уравнения происходящих реакций.
5.Медь находится в контакте с никелем и опущена в разбавленный раствор серной кислоты, какой процесс происходит на аноде?
6.Составьте схему гальванического элемента, в основе которого лежит реакция, протекающая по уравнению:
Ni + Pb(NO3)2= Ni(NO3)2+Pb
7. Марганцевый электрод в растворе его соли имеет потенциал 1, 23 В. Вычислите концентрацию ионов Mn2+ в моль/л.
Время, отведенное на лабораторную работу
| Подготовка к работе | 1 час |
| Выполнение работы | 2 часа |
| Обработка результатов эксперимента и оформление отчета | 1часа |
ЛИТЕРАТУРА
Основная
1.Коровин Н.В.Общая химия. учебн. для технических направлений и спец.вузов.-М.: Высш.шк., 2002.-559с.; ил.
2.Некрасов Б.В.Основы общей химии.-Т.1, 2.-М..Химия, 1973.-650 с.
Дополнительная
1.Коровин Н.В. Общая химия: учебн.для техн.направлени й и спец.вузов.-М.: Высш.шк., 2002.-599с.; ил
2.Некрасов Б.В. Основы общей химии.Т.1, 2.-М.: Химия, 1973, -650 с.
|
|