
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Д. И. Менделеева
|
|
Периодическая система элементов Д. И. Менделеева и электронная структура атомов. В 1869 г. Д. И. Менделеев сообщил об открытии периодического закона, современная формулировка которого следующая: свойство элементов, а также формы и свойства их соединений находятся в периодической зависимости от заряда ядра их атомов. Наглядным выражением закона служит периодическая система Д. И. Менделеева. К настоящему времени предложено большое число вариантов системы. Наиболее общепризнанным являются короткая и длинная системы.
Рассмотрим связь между положением элемента в периодической системе и электронным строения его атомов. У каждого последующего элемента периодической системы на один электрон больше, чем у предыдущего. Полные записи электронных конфигураций первых двух периодов приведены в таблице.
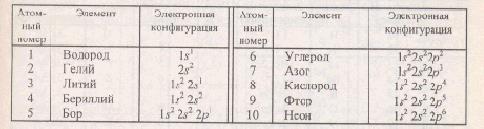 |
Первый период состоит из двух элементов: водорода и гелия. Атомом гелия заканчивается формирование К-оболочки атома, обозначим ее [Не]. Электрон, который последним заполняет орбитали атома, называется формирующим, и элемент относится к группе, называемой по формирующему электрону. В данном случае оба элемента имеют формирующие S-электроны и соответственно называются s-э л е м е н т а м и.
У элементов второго периода формируется Z-оболочка, заполняются s- и p-подоболочки. Формирующими электронами у первых двух элементов являются s-электроны, поэтому Li и Be относятся к s-элементам. Остальные шесть элементов периода входят в число р-э лементов, так как формирование их орбиталей заканчивается p-электроном. У элемента Ne полностью заполнена 2р- подоболочка, обозначим его электронную конфигурацию как [Ne]. В табл. 1.3 даны в краткой записи электронные конфигурации элементов в основном состоянии. При этом не приводится полная запись электронной конфигурации полностью заполненных подоболочек предыдущих периодов.
Третий период начинается с натрия, электронная конфигурация которого 1s22s22p63s1 и заканчивается аргоном с электронной конфигурацией Is22s22p63s23p6 [Ar]. Хотя в третьем уровне (оболочка М) имеется подоболочка 3d, которая остается незаполненной, в четвертом периоде начинает формироваться следующая оболочка. N (n=4) и период начинается с p-элемента калия, [Ar] 4s1. Это обусловлено тем, что энергия подуровня 4s несколько ниже, чем энергия подуровня 3d. В соответствие с правилом Клечковского n+1 у 4s(4) ниже, чем п+1 у 3d(5). После заполнения 4s-подоболочки заполняется 3d-подоболочка. Элементы, начиная со Sc [Ar] 3dl4s2 до Zn [Ar] 3d104s2, имеющие формирующие d-электроны, относятся к d- элементам. У хрома на 4s-подоболочке остается один электрон, а на Зd-подоболочке вместо четырех, оказывается, пять d-электронов. Такое явление получило название «провала» электрона с s- на d-подоболочку. Это обусловлено более низкой энергией конфигурации 3d54s1 по сравнению с конфигурацией 3d44s2. «Провал» электронов наблюдается и у других атомов, например у атомов Cu, Nb, Mo, Pt, Pd.
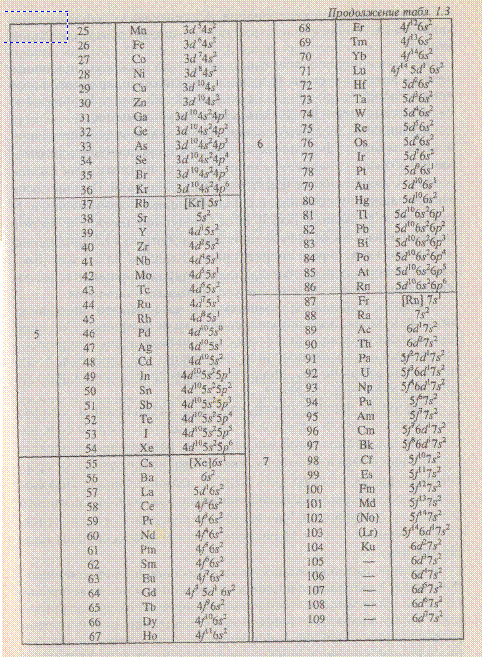
Четвертый период завершается формированием подоболочки 4р у криптона [Ar] 3d104s24p6 или [Кr]. Всего в четвертом периоде 18 элементов.
Пятый период аналогичен четвертому периоду. Он начинается с s-элемента рубидия [Кr] 5s1 и заканчивается р-элементом ксеноном [Кr] 4d105s25p6 или [Хе] и включает в себя десять 4d-элементов от иттрия до кадмия. Всего в пятом периоде 18 элементов.
В шестом периоде, как и в пятом, после заполнения s-подоболочки начинается формирование d-подоболочки предвнешнего уровня у лантана. Однако, у следующего элемента энергетически выгоднее формирование 4f-подоболочки по сравнению с 5d-подоболочкой. Поэтому после лантана следует 14 лантаноидов с формирующими f -электронами, т.е. f- элементов от церия Се [Хе] 4f25d°6s2 до лутеция Lu [Хе] 4f145d16s2. Затем продолжается заполнение оставшихся орбиталей в 5d-подоболочке и 6р-подоболочке. Период завершает радон [Хе] 4f145d106s26p6 или [Rn]. Таким образом период имеет 32 элемента: два 5-элемента, шесть p-элементов, десять d-элементов и четырнадцать f-элементов.
Седьмой период начинается и продолжается аналогично шестому периоду, однако формирование его не завершено. Он также имеет вставную декаду из d-элементов и четырнадцать 5f-элементов (актиноидов). К настоящему времени известно 109 элементов, в том числе семь 6d-элементов. Элементы, начиная со 105 номера, пока не имеют официального названия.
Структура периодической системы. Периодическая система элементов состоит из периодов, групп и подгрупп. Периодом называется последовательный ряд элементов, размещенных в порядке возрастания заряда ядра атомов, электронная конфигурация которых изменяется от nsl до ns2np6 (или до ns2 у первого периода). Периоды начинаются с s-элемента и заканчиваются p-элементом (у первого периода — s-элементом). Малые периоды содержат 2 и 8 элементов, больше периоды — 18 и 32 элемента, седьмой период остается незавершенным.
В системе имеется восемь групп, что соответствует максимальному числу электронов во внешних подоболочках. Группы делятся на главные (основные) и побочные подгруппы. Подгруппы включают в себя элементы с аналогичными электронными структурами (элементы-аналоги). К главным подгруппам (подгруппам А) относятся подгруппы элементов второго периода: Li, Be, В, С, N, О, F и подгруппа благородных газов. К побочным подгруппам (подгруппам В) принадлежат d- и f -элементы. Первые шесть d-элементов (от Sc до Fe) начинают соответствующие подгруппы от подгруппы III (Sc) до подгруппы VIII (Fe). В подгруппу VIII также включаются все элементы семейства железа (Fe, Co, Ni) и их аналоги — платиновые металлы. Медь и ее аналоги, имеющие во внешней s-подоболочке по одному электрону, образуют первую побочную подгруппу, а цинк и его аналоги — вторую побочную подгруппу. Лантаноиды и актиноиды (f -элементы) находятся в III подгруппе в соответствие с особенностями их электронных конфигураций.
|
|