
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Охрана воздушного бассейна
|
|
Выбросы вредных веществ в атмосферу. Основные антропогенные атмосферные выбросы вредных веществ вызваны сжиганием органического топлива на электростанциях, в котельных, промышленных печах и двигателях внутреннего сгорания, а также переработкой руд и получением различных химических продуктов.
Суммарные антропогенные выбросы на нашей планете в 80-х годах составляли (т/год): пыль и сажа — (8—16) * 108, оксид углерода — (2—3)*108, оксиды серы —(8—15)*107, оксиды азота — ( 4—8, 5) *107.
Кроме того, в атмосферу поступают углеводороды, свинец, ртуть, мышьяк, летучие химические реагенты и продукты, радиоактивные изотопы. Например, анализ показал, что воздух Санкт-Петербурга содержит 33 углеводорода и их производных. Основная часть выбросов поступает от тепловых электростанций (до 21%), предприятий металлургии, нефтедобычи и нефтепереработки, автотранспорта. Значительная часть вредных атмосферных выбросов обусловлена горением топлива.
Продукты горения топлива зависят от его состава и условий сжигания. Однако при горении топлива на электростанциях, в промышленных печах, двигателях внутреннего сгорания и других установках всегда образуются Н2О, СО2 и СО. Соотношение между СО2 и СО в продуктах горения зависит от ряда факторов и прежде всего от соотношения топлива и воздуха. Если подача воздуха недостаточна, то топливо сгорает неполностью, в продуктах горения увеличивается доля СО и сажи, при этом КПД использования топлива понижается. В то же время большой избыток воздуха ухудшает эффективность работы установок, так как при этом необходимы дополнительные затраты теплоты на подогрев воздуха. Температура топливо-воздушной смеси на некоторых участках может упасть ниже температуры воспламенения топлива, из-за чего часть его не успевает сгореть. Поэтому должно соблюдаться оптимальное соотношение между топливом и воздухом. Лучше всего контролировать это соотношение по содержанию СО и СО2 в продуктах горения.
Кроме паров воды и оксидов углерода, продукты горения топлива содержат оксиды серы и азота, азот, непрореагировавший кислород и другие вещества. Оксиды серы образуются по реакции окисления серы
S+O2=SO2 SO2+ 1 /2O2=SO3
и серосодержащих соединений, а также разложения сульфидных соединений. Основная часть оксидов азота поступает в атмосферу от автотранспорта и тепловых электростанций. Оксиды азота образуются за счет окисления, как азота воздуха, так и азота топлива. Реакции протекают по цепному механизму, например, по схеме:
O2 + N2 =NO2 + N*
N* + O2 =NO + O*
N*+ О* -> NO*
Атомарный и молекулярный кислород образуют токсичный озон.
В реакции окисления принимают участие радикалы, образующиеся при окислении или разложении топлива, например СН:
CT* + N2=HCN + N*
OH* + N*=NO + H*
Химические процессы ускоряются под действием солнечных лучшей.
Продукты горения топлива содержат также углеводороды, в частности бенз(а)пирен C20H12, обладающий канцерогенными свойствами. В продуктах горения твердого топлива и мазута имеется значительная доля твердых веществ: золы, сажи и др.
Количество и состав продуктов горения зависят от состава исходного топлива и условий горения.
При сжигании мазута и угля вредными основными выбросами являются оксиды серы и азота, при сжигании газа — оксиды азота. Кроме того, среди вредных выбросов электростанций, работающих на угле, могут быть ртуть, бериллий, свинец, кадмий, уран, хром, сурьма, ванадий, марганец и другие, экологически опасные элементы.
На долю энергетики приходится более 70% всех выбросов оксидов серы и более 40% выбросов оксидов азота. Заметный вклад в загрязнение атмосферы вносит транспорт. В среднем автомобиль выбрасывает в атмосферу (кг/год): монооксида углерода — 135, оксидов азота — 25, углеводородов — 20, оксидов серы — 4, твердых частиц — 1, 2.
В настоящее время в мире эксплуатируется около 500 млн. автомобилей и число их непрерывно возрастает, соответственно растут и вредные выбросы в атмосферу.
Особенно опасен автотранспорт в крупных городах. Например, выброс вредных соединений от автомобилей в 1988 г. составил (тыс. т/год): в Москве — 840, С.-Петербурге — 370, Ташкенте — 310. В последние годы число автомобилей и соответственно масса выбросов в городах значительно возросли. В крупных городах возникает особое явление, называемое смогом.
В настоящее время антропогенные выбросы в атмосферу оказывают влияние не только на окружающую среду, но и на целые континенты и даже на климат на Земле. К числу таких глобальных последствий относятся разрушение озонового слоя, «парниковый» эффект и кислотные дожди.
Кислотные дожди. В атмосфере образуются H2SO3 и H2SO4, при взаимодействии оксидов серы с водой
SO2+ H2O=H2SO3
SO3+ Н2О=H2SO4
и HNO3 в результате реакции NO2 с водой
2NO2 + Н2О = HNO3 + HNO2
Кислоты в виде мелких капель (0, 1—1, 0 мкм) переносятся на большие расстояния, иногда на сотни километров, и выпадают в виде кислотных дождей (рН < 5, 6, иногда до рН4). Попадая в почву, вода нейтрализуется за счет ионного обмена. Однако, вода с низким значением рН может растворять соединения токсичных тяжелых металлов, а при недостаточной обменной емкости почвы подкисляет ее, что снижает урожай и вредит лесам.
Происходит заметное подкисление озер и прудов, которые становятся мертвыми. Кислотные дожди также вызывают коррозию металлов и разрушение мраморных и известковых конструкций и произведений искусства.
«Парниковый» эффект». Диоксид углерода прозрачен для солнечного света, но не пропускает в атмосферу инфракрасное излучение Земли, т.е. ведет себя подобно полиэтиленовой пленке в парнике. В связи с возрастанием темпов сжигания топлива растет концентрация диоксида углерода в атмосфере. Ожидается, что к 2050 г. концентрация СО2 удвоится по сравнению с 1978 г., что вызовет повышение средней температуры на Земле на 2, 5—3, 5 К и соответственно таяние ледников и повышение уровня Мирового Океана. По прогнозам некоторых специалистов уровень Океана в 2050 г. может подняться на 4—5 м, что приведет к затоплению огромных территорий. Аналогично СО2, на инфракрасное тепловое излучение воздействуют метан и другие углеводороды, которые поступают в атмосферу при добыче и переработке нефти и газа, а также из газовых криогидратов (клатратов) при таянии ледников. До некоторой степени «парниковый» эффект компенсируется образованием аэрозолей твердых и жидких частиц, выбрасываемых в атмосферу в результате природных процессов и жизнедеятельности человека. Аэрозоли снижают способность атмосферы пропускать солнечный свет и соответственно снижают среднюю температуру земной поверхности. Тем не менее человечеству необходимо снизить поступление СО2 в атмосферу. Экономически приемлемых путей решения этой проблемы пока не найдено.
Зашита воздушного бассейна от загрязнения. Защита воздушного бассейна от загрязнений стала одной из важных и сложных задач, стоящих перед человечеством. Решение этой задачи осуществляется по трем направлениям: обезвреживание выбросов, изменение состава топлива и разработка новых методов преобразования энергии и новых технологий. На первом этапе использовался и пока еще используется первый путь. Тепловые электростанции оборудуются высокими трубами для рассеивания выбросов в более высокие слои атмосферы. Электростанции и металлургические заводы имеют золоуловители для удаления золы из продуктов горения, фильтры и адсорберы для сорбции некоторых газов и твердых частиц.
Оксиды серы и азота, имеющие кислотный характер, нейтрализуются веществами основного характера. Для нейтрализации оксида серы используется известь, известняк, оксид магния и другие вещества:
SO2 + СаСОз + '/2Н2О = CaSO3) * '/2H2O + СО2
SO2 + Са(ОН)2 = CaSO3 * '/2H2O + '/2H2O
SO2 + MgO + 6H2O = MgSO3 * 6H2O
SO2 + (NH4)2SO3 + H2O = 2NH4HSO3
Оксиды азота нейтрализуются известью, содой, аммиаком и другими веществами:
2NO2 + Na2CO3 = NaNO2 + NaNO3 + CO2
4NO2 + 2Ca(OH)2 = Ca(NO3)2 + Ca(NO2)2 + 2H2O
2NO2 + 2NH4OH = NH4NO3 + NH4NO2 + H2O
Оксиды азота и серы обезвреживаются также методом каталитического восстановления, например:
4NO + СН4 - 2N2 + СО2 + 2Н2О
2NO2 + СН4 = N2 + СО2 + 2Н2О
Диоксид серы и монооксид углерода можно окислить на катализаторах:
SO2 + '/2О2 = SO3
SO3 + Н2О = H2SO4
СО + '/2О2 = СО2
Для окисления монооксида углерода и восстановления оксидов азота в автомобилях предложены катализаторы, которые могут устанавливаться в выхлопных трубах и представляют собой пористую насадку с катализатором, например, платиной или палладием и родием. Газовые выбросы можно также очищать методом адсорбции на активированном угле, силикагелях и цеолитах и других адсорбентах.
Однако обезвреживание продуктов горения и выбросов металлургических заводов весьма дорого, и в будущем, по-видимому, будут применяться другие методы защиты воздушного бассейна.
В настоящее время ученые разрабатывают энергохимические методы использования топлива. Сущность этих методов заключается в предварительной химической переработке топлива, очистке от серы и разделения его на фракции. Некоторые фракции могут служить ценным сырьем для химической промышленности, а другие фракции — топливом для электростанций. Очищенное топливо при горении будет давать значительно меньше вредных выбросов.
Наиболее кардинальным решением проблемы защиты воздушного бассейна является разработка новых методов преобразования энергии и новых машин, обеспечивающих безвредные выбросы, а также применение менее вредных веществ. Так, например, происходит замена галогеносодержащих хладонов на новые соединения, не разрушающие озонового слоя в верхних слоях атмосферы. Существенного уменьшения загрязнение воздушного бассейна можно достичь, если осуществить идеи водородной энергетики.
Водородная энергетика. Стоимость передачи энергии в химической форме (в виде газа) значительно ниже стоимости передачи электроэнергии. В качестве носителя энергии может быть использован водород. В настоящее время ведутся широкие исследования будущих энергетических систем, в которых передача и распределение энергии будут осуществляться с помощью водорода. Применение водорода значительно снизит уровень загрязнения атмосферы, так как при его окислении образуется безвредный продукт — вода.
Природные запасы соединений водорода огромны. Водород легко вступает в химические реакции, при его окислении выделяется большое количество теплоты. Поэтому водород может найти широкое применение в промышленности и быту, для синтеза различных соединений, освещения, отопления и охлаждения, приготовлении пищи и для получения электроэнергии с помощью электрохимических генераторов.
Водородная энергетическая система будет иметь установки для получения водорода, подсистемы его передачи и распределения и установки для его использования. Существует большое количество способов получения водорода. Наиболее широко в настоящее время применяются способы пароводяной конверсии и электролиза. В последнее время большое внимание уделяется фотохимическому способу получения водорода. В перспективе при разработке термоядерных реакторов может стать экономически целесообразным получение водорода термохимическим разложением воды. Таким образом, водородную энергетическую систему с учетом различных способов получения водорода и путей его использования можно представить схемой.
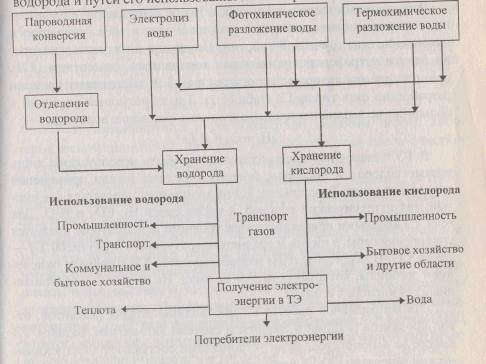 |
Водород можно получить за счет пароводяной конверсии метана или угля:
СH4 + H2O = CO +3H2
С + Н2О = СО + Н2
СO + Н2О = СО2 + Н2
При этом водород необходимо отделить от диоксида углерода и других продуктов конверсии. Эту проблему еще нельзя считать разрешенной. Одним из основных методов получения водорода в недалеком будущем рассматривается электролиз на атомных электростанциях. Кроме водорода выделяется и кислород, который также может быть использован в промышленности и быту. Кроме электролитического, рассматриваются и фотохимические методы получения водорода. Термохимический метод получения может быть особенно перспективен при разработке термоядерных энергоустановок. Однако для применения этого метода необходимо решить задачу разделения водорода и кислорода. Большой интерес вызывает фотохимический способ разложения воды с использованием биологических катализаторов.
Электрохимическая энергетика. Новое направление в энергетике — электрохимическая энергетика включает в себя генерацию и накопление электрической энергии. Генерация электроэнергии происходит в устройствах, называемых топливными элементами (ТЭ). К настоящему времени разработано пять типов ТЭ.Токообразующей реакцией в большинстве топливных элементов служит окисление водорода:
2Н2 + О2 = Н2О
В ТЭ с щелочным электролитом могут быть использованы лишь чистые водород и кислород, поэтому они пока нашли применение только в космосе. В остальных ТЭ на анод может подаваться как чистый, так и технический водород, а также смесь Н2, СО2 и Н2О. Для всех ТЭ вредными примесями, отравляющими катализаторы, являются соединения серы, в низко- и среднетемпературном ТЭ (до t =200°С) — также СО. В последние годы разрабатываются ТЭ с прямым окислением метанола, который подается на анод. На катоде ТЭ восстанавливается кислород воздуха.
Для непрерывной работы ТЭ необходимы подача реагентов, отвод продуктов реакции и теплоты и система автоматики. Батарея ТЭ вместе со вспомогательными устройствами составляют электрохимический генератор (ЭХГ), который в свою очередь входит в электрохимическую энергоустановку, которая состоит из блока переработки топлива, инвертора постоянного тока в переменный и устройств использования теплоты либо для теплоснабжения, либо для дополнительной выработки электроэнергии в концевом цикле, состоящем из газовой или паровой турбины или парогазовой системы. В качестве исходного топлива может служить природный газ или уголь. Природный газ подвергается конверсии водяным паром:
СН4 + 2Н2О = СО2 + 4Н2
Уголь газифицируется либо обработкой водяным паром, либо термическим пиролизом, продукты переработки угля после очистки от вредных примесей поступают в топливные элементы.
В ТЭ окислитель и топливо пространственно разделены, поэтому даже при высоких температурах образуется значительно меньше оксидов азота и монооксида углерода, чем в тепловых машинах. Выброс вредных компонентов из электрохимических энергоустановок на 1, 5— 2 порядка ниже, чем из тепловых машин. Это главное преимущество электрохимических энергоустановок. Их можно устанавливать непосредственно около потребителя. Важным достоинством электрохимических энергоустановок также является высокий КПД, который в 1, 5—2 раза выше КПД тепловых машин. При этом КПД электрохимических энергоустановок относительно мало зависит от их установленной мощности и нагрузки.
К настоящему времени созданы установки мощностью от 10 кВт до 11 МВт, некоторые из них уже находятся в коммерческой реализации.
На первых порах эти установки, и прежде всего на основе низкотемпературных ТЭ, будут применяться для автономного энергоснабжения отдаленных районов, отдельных островов, поселков, отдельных жилых и промышленных зданий, торговых и спортивных центров и т.д. Позднее, по мере их удешевления и увеличения срока службы, они найдут применение и для централизованной генерации электроэнергии. Ожидается, что к 2015 г. они будут генерировать до 10%, а к 2030 г. до 25—30% всей электроэнергии.
Проблема электромобиля. Одним из наиболее кардинальных решений проблемы снижения вредных выбросов транспортных устройств является замена двигателя внутреннего сгорания на экологически чистые устройства и прежде всего на батареи аккумуляторов или на электрохимические энергоустановки. К батарее аккумуляторов для электромобиля предъявляются требования высокой удельной энергии и мощности на единицу массы и объема, срока службы, экологической чистоты, простоты обслуживания и невысокой стоимости. Традиционные аккумуляторы удовлетворяют не всем указанным требованиям. Так, свинцовые аккумуляторы слишком тяжелы, они обеспечивают пробег электромобиля без подзарядки при скорости 60 км/ч не более 70—90 км. Поэтому такие электромобили могут использоваться лишь для внутригородских перевозок продуктов и промышленных товаров и доставки почты.
Никель-кадмиевые аккумуляторы очень дороги и содержат токсичный кадмий. При замене кадмия на цинк или интерметаллид получают никель-цинковый или никель-металлгидридный Ni -MH аккумулятор, которые обеспечивают пробег электромобиля без подзарядки до 120—140 км, однако срок службы Ni - Zn аккумулятора не превышает двух-трех лет, a Ni - МН аккумулятор пока дорог.
Новые аккумуляторы, такие как воздушно-цинковый с щелочным электролитом и литиевый с неводным электролитом обеспечивают пробег электромобиля без подзарядки 150— 300 км, однако еще пока недостаточно разработаны. После снижения стоимости аккумуляторов и их доработки до промышленного производства удастся создать электромобили, которые найдут широкое применение. В другом типе разрабатываемых электромобилей применяются электрохимические энергоустановки на основе топливных элементов работающих на водороде и метаноле. В настоящее время испытываются несколько демонстрационных электробусов и электромобилей на основе ТЭ с твердополимерными и фосфорнокислыми электролитами. Основная задача, стоящая перед разработчиками, — это снижение стоимости и увеличение срока службы энергоустановок.
Итак, в настоящее время тепловые электростанции, двигатели внутреннего сгорания, металлургические и другие заводы выбрасывают в атмосферу огромное количество вредных газов и прежде всего оксидов азота, серы и монооксида углерода. Принимаются меры по снижению этих выбросов и их нейтрализации. Однако, эти меры недостаточно эффективны. Более перспективны направления создания новых технологий и устройств, например, развитие водородной и электрохимической энергетики и создание электромобиля.
|
|