
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
ДНК-полимераза b
|
|
ДНК-полимераза b (Polb) млекопитающих является самой маленькой из известных эукариотических ДНК-полимераз и относится к семейству Х, к которому принадлежит, например, и терминальная нуклеотидилтрансфераза. Polb имеет длину 335 остатков (мол. масса 39 кД) и состоит из двух доменов, соединенных чувствительным к протеазам линкером. Короткий N-концевой домен (8 кД) может связываться с онДНК и с 5’-концом нити ДНК в ОР или однонитевой бреши. Этот домен обладает 5’-дезоксирибозофосфатазной активностью, т.е. способен удалять с 5’-конца нити ДНК остатки 5’-дезоксирибозофосфата (без присоединенного к сахару основания) или 5’-дезоксирибонуклеотидфосфата. Эта реакция идет по механизму b-элиминации, а не гидролиза. На промежуточной стадии отщепляемый 5’-дезоксирибозофосфат ковалентно связывается с остатком лизина в домене 8 кД.
С-концевой домен (31 кД) обладает полимеразной активностью, которая способна заполнять в днДНК короткие однонитевые пробелы по дистрибутивному механизму. ДНК-полимераза b обычно ресинтезирует в ДНК участки длиной 1-2 остатка, отрываясь от конца затравки после каждого акта включения нуклеотида. Подобно другим ДНК-полимеразам, 3-мерная структура Polb содержит домены ладони, большого пальца и пальцев, но они сильно редуцированы (рис. 1.12). В домене ладони находится триада остатков асп (положения 190, 192 и 256), участвующая в связывании двух каталитических катионов Mg2+. Однако по механизму связывания матрицы Polb отличается от других ДНК-полимераз. Это может обусловливать дистрибутивный характер ее действия.
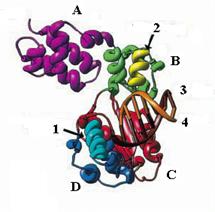
Рис. 1.12. Модель 3-мерной структуры тройного комплекса ДНК-полимеразы b крысы с ДНК и ди-дНТФ.
1 – сайт связывания входящего нуклеотида, 2 – сайт связывания ДНК, 3 – матрица, 4 – затравка
А – N-концевой домен, В – аналог домена большого пальца, С – домен ладони, D – аналог домена пальцев
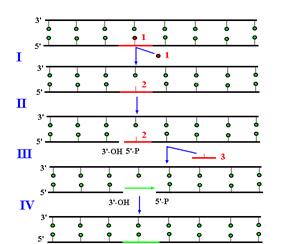
Рис. 1.13. Участие ДНК-полимеразы b в эксцизионной репарации оснований с короткими заплатками.
I – удаление модифицированного основания ДНК-гликозилазой, II – образование ОР с 5’-стороны от АР-сайта АР-эндонуклеазой, III– удаление АР-сайта с освобождением 5’-дезоксирибозофосфата, IV – заполнение однонитевого пробела ДНК-полимеразой b и лигирование ДНК-лигазой.
1 – модифицированное основание, 2 – АР-сайт, 3 – 5’-дезоксирибозофосфат.
Уже давно было установлено, что ДНК-полимераза b участвует не в репликации, а в репарации ДНК. Две каталитические активности Polb делают ее идеально приспособленной к участию в эксцизионной репарации оснований (рис. 1.13). В клетках человека Polb отвечает за репарацию 75% повреждений ДНК, исправляемых по этому механизму. К числу таких повреждений относятся остатки урацила, ошибочно встроенные репликативными ДНК-полимеразами вместо тимина, а также некоторые типы модифицированных оснований, возникающие при действии на ДНК алкилирующих агентов, окислительных агентов и ионизирующей радиации. Первый этап этого пути (удаление модифицированного основания) катализируют ДНК-гликозилазы (например, урацил-ЛНК-гликозилаза), которые разрушают N-гликозидную связь между основанием и дезоксирибозой в остове ДНК. В результате их действия в ДНК образуется апуриновый/апиримидиновый АР-сайт. Этот сайт узнается АР-эндонуклеазами. Некоторые из них вызывают появление ОР с 3’-гидроксильным и 5’-фосфатным концами, расположенного с 5’-стороны от АР-сайта. Этот ОР служит местом посадки ДНК-полимеразы b, которая вначале за счет 5’-дезоксирибозофосфатазной активности удаляет из поврежденной нити 5’-дезоксирибозофосфат (т.е. убирает АР-сайт), а затем заполняет образовавшийся однонуклеотидный пробел полимеразной активностью. Завершает репарацию воссоединение ОР под действием ДНК-лигазы.
Трансгенные мыши с гомозиготной делецией гена Polb нежизнеспособны: их эмбрионы выживают только в течение 10 дней после оплодотворения. Линии клеток млекопитающих, гомозиготные по делеции этого гена, сохраняют жизнеспособность, но проявляют дефект по эксцизионной репарации оснований и имеют повышенную чувствительность к алкилирующим агентам (но не к УФ-свету и ионизирующей радиации).
У дрожжей S. cerevisiae имеется ген POL4, который кодирует белок длиной 582 остатка. С-концевая область этого белка гомологична ДНК-полимеразам b млекопитающих и содержит 5’-дезоксирибозофосфатазный и полимеразный домены. Функции N-концевого удлинения (~200 остатков) неизвестны. Нулевые мутанты дрожжей по гену POL4 не дефектны по эксцизионной репарации оснований и не проявляют повышенную чувствительность к алкилирующим агентам. Биологическая роль продукта гена POL4 пока окончательно не установлена. Дрожжевой белок Pol4 является ортологом ДНК-полимеразы l млекопитающих.
|
|