
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Соли, образованные сильным основанием и сильной кислотой, гидролизу не подвергаются.
|
|
В этом случае равновесие диссоциации воды в присутствии ионов соли почти не нарушается. Поэтому растворы таких солей имеют практически нейтральную реакцию среды.
В растворе хлорида натрия (NaCl) гидролиз не протекает, так как соль образована сильным основанием и сильной кислотой. Среда нейтральная, рН = 7.
Если соль содержит однозарядный катион (анион) и многозарядный анион (катион), то возможен ступенчатый гидролиз. Образующиеся в результате гидролиза по первой ступени по аниону кислые соли могут подвергаться дальнейшему взаимодействию с водой. Однако вторая и последующая ступени гидролиза выражены менее сильно. Это обусловлено изменением величин констант диссоциации соответствующих электролитов.
Например, поскольку ион 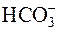 диссоциирует слабее, чем Н2СО3, то он образуется, в первую очередь, при гидролизе карбоната натрия (Na2CO3):
диссоциирует слабее, чем Н2СО3, то он образуется, в первую очередь, при гидролизе карбоната натрия (Na2CO3):
I ступень: Na2CO3 + Н2О D NaНСО3 + NaOH,
II ступень: NaНСО3+ Н2О D NaOH + H2CO3.
Гидролиз солей слабых многоосновных кислот по второй и третьей ступеням протекает мало и содержание в растворе продуктов гидролиза по этим ступеням незначительно и их можно не учитывать в расчетах.
Сульфаталюминия Al2(SO4)3 – в водном растворе соль подвергается гидролизу, так как образована слабым основанием и сильной кислотой. Среда – кислая. Гидролиз протекает в малой степени и, преимущественно, по первой ступени.
Молекулярное уравнение гидролиза:
Al2(SO4)3 + 2Н2О D 2AlOHSO4 + H2SO4.
Полное ионно-молекулярное уравнение гидролиза:
2Al3+ + 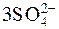 + 2HOH D 2AlOH2+ + 2H+ +
+ 2HOH D 2AlOH2+ + 2H+ + 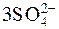
среда кислая рН < 7.
Краткое ионно- молекулярное уравнение гидролиза:
2Al3+ + 2HOH D 2AlOH2+ + 2H+,
Al3+ + HOH D AlOH2+ + H+.
Гидролиз солей, в ряде случаев, может протекать очень сложно. Продукты гидролиза некоторых солей можно установить точно лишь на основании аналитического исследования.
Поскольку при обратимом гидролизе устанавливается динамическое равновесие, то, в соответствии с законом действующих масс, можно сместить равновесие в ту или иную сторону введением в раствор кислоты или основания. Этим часто пользуются для усиления или подавления процесса гидролиза.
Константа диссоциации воды увеличивается при повышении температуры в большей степени, чем константы диссоциации продуктов гидролиза – слабых кислот и оснований, поэтому при нагревании степень гидролиза возрастает.
Так как реакция нейтрализации является реакцией экзотермической, то гидролиз, будучи противоположным ей процессом, эндотермичен. Поэтому, в соответствии с принципом Ле-Шателье, повышение температуры вызывает усиление гидролиза.
В соответствии с тем же принципом процесс гидролиза проходит полнее при разбавлении раствора, так как увеличивается концентрация воды.
Одной из количественных характеристик процесса гидролиза является степень гидролиза (h).
Степень гидролиза – это отношение числа молекул, подвергшихся гидролизу (N) к общему числу молекул в растворе (N 0):
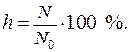
Степень гидролиза изменяется в пределах от 0 до 100 %.
Другой количественной характеристикой процесса гидролиза является константа гидролиза, характеризующая собой равновесия процесса гидролиза.
Если соль образована слабой кислотой, то константа гидролиза равна отношению константы воды и константы диссоциации слабой кислоты (см. табл. 8 приложения).
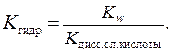
Если соль образована слабым основанием, то константа гидролиза равна отношению константы воды и константы диссоциации слабого основания.
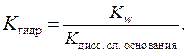
Если соль образована слабым основанием и слабой кислотой, то константа гидролиза равна отношению: в числителе – константа воды, а в знаменателе – произведение констант диссоциации слабой кислоты и слабого основания.
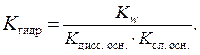
Из приведенных формул следует, что чем слабее электролит, образовавший соль, тем больше значение константы гидролиза и тем глубже протекает процесс гидролиза. Значения величин констант диссоциации ряда слабых кислот приведены в табл. 8 приложения.
9.3. Вопросы для самоконтроля.
1. На какие ионы диссоциирует молекула воды?
2.Что представляет из себя водородный показатель среды?
3. Что представляет из себя гидроксилный показатель среды?
4. Какое значение имеет концентрация ионов водорода в чистой воде при 25 º С?
5. Как связаны между собой водородный и гидроксильный показатели?
6. Что такое ионное произведение воды?
7. Какое значение имеет величина ионного произведения воды при стандартных условиях?
8. Какими значениями рН характеризуются:
а) нейтральные среды,
б) кислые среды,
в) щелочные среды?
9. Какую окраску имеют наиболее распространенные индикаторы (лакмус, метилоранж и фенолфталеин) в нейтральной, кислой и щелочной средах?
10. Что такое гидролиз солей?
11.Какие вещества подвергаются гидролизу?
12. Какие соли подвергаются гидролизу?
13. Чем должна быть образована соль, при гидролизе которой получается: а) основная соль, б) кислая соль?
14. Наличием каких ионов в составе гидролизующейся соли определяется реакция среды в ее растворе?
15. В каком случае гидролиз соли протекает практически полностью?
16. Какими количественными характеристиками можно оценить процесс гидролиза?
17. От каких факторов зависит процесс гидролиза?
18. Каим образом следует изменить температуру, чтобы усилить процесс гидролиза соли?
19. Каким образом следует изменить концентрацию раствора, чтобы усилить процесс гидролиза соли?
|
|