
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Химическая кинетика. Вопрос: При каких концентрациях (моль/л) йода (CI) и водорода (CH) скорость реакции H2 + I2 => 2HI численно равна удвоенной константе скорости.
|
|
Вопрос:
При каких концентрациях (моль/л) йода (CI) и водорода (CH) скорость реакции H2 + I2 => 2HI численно равна удвоенной константе скорости?
1. CH = 0.2 CI = 2.0
2. CH = 0.2 CI = 6.5
3. CH = 0.5 CI = 4.0
4. CH = 5.0 CI = 0.2
5. CH = 3.9 CI = 3.3
Ответ: 3
Правильно!
Вопрос:
Как изменится скорость прямой реакции в системе O2 + 4HCl → 2H2O + 2Cl2, если объем смеси увеличить в 2 раза.
1. увеличится, x4
2. увеличится, x16
3. уменьшится, x32
4. увеличится, x32
5. уменьшится, x16
Ответ: 3
Правильно!
Вопрос:
В какой из приведенных газофазных реакций равновесие сдвигается влево с повышением давления?
1. CH4 + 2H2S < => CS2 + 4H2
2. 2SO2 + O2 < => 2SO3
3. H2 + I2 < => 2HI
4. 2CO + O2 < => 2CO2
5. N2 + O2 < => 2NO
Ответ: 1
Правильно!
Вопрос:
Равновесные концентрации веществ (моль/л) в реакции 2NO + O2 < => 2NO2 оказались равными 3, 1.5, 1 (в порядке записи в реакции). Во сколько раз снизилось давление в системе по отношению к первоначальному?
1. 3/2
2. 4/3
3. 62/57
4. 12/11
5. 33/25
Ответ: 2
Неправильно!
Вопрос:
Во сколько раз увеличится скорость реакции при увеличении температуры на 20℃, если температурный коэффициент скорости равен 2.6?
1. 6.76
2. 5.20
3. 52.00
4. 1.30
5. 26.50
Ответ: 1
Правильно!
Вопрос:
При каких концентрациях (моль/л) кислорода (CO) и оксида углерода (CC) скорость реакции 2CO + O2 => 2CO2 численно равна удвоенной константе скорости?
1. CC = 0.4 CO = 2.5
2. CC = 5.0 CO = 0.04
3. CC = 1.9 CO = 1.6
4. CC = 2.0 CO = 0.25
5. CC = 2.0 CO = 0.5
Ответ: 5
Правильно!
Вопрос:
Скорость какой из реакций выразится уравнением v = k[O2]?
1. 2SO2 + O2 => 2SO3
2. 2H2O => 2H2 + O2
3. Si + O2 => SiO2
4. 2CO + O2 => 2CO2
5. N2 + O2 => 2NO
Ответ: 3
Правильно!
Вопрос:
В какой из приведенных газофазных реакций равновесие сдвигается вправо с повышением давления?
1. CH4 + 2H2S < => CS2 + 4H2
2. 2SO2 + O2 < => 2SO3
3. H2 + I2 < => 2HI
4. 2CO2 < => O2 + 2CO
5. N2 + O2 < => 2NO
Ответ: 2
Правильно!
Вопрос:
Исходные концентрации азота и водорода в реакции N2 + 3H2 < => 2NH3 равны 3 и 5.6 моль/л соответственно. К моменту достижения равновесия в реакцию вступило 30% исходного азота. Чему равна константа равновесия?
1. 0.06326
2. 0.0071
3. 0.543
4. 1.2852
5. 0.00121
Ответ: 1
Правильно!
Вопрос:
Во сколько раз увеличится скорость реакции при увеличении температуры на 20℃, если температурный коэффициент скорости равен 3.3?
1. 6.60
2. 5.20
3. 10.89
4. 0.66
5. 26.50
Ответ: 3
Правильно!
Вопрос:
При каких концентрациях (моль/л) кислорода (CO) и оксида углерода (CC) скорость реакции 2CO + O2 => 2CO2 численно равна удвоенной константе скорости?
1. CC = 0.4 CO = 2.5
2. CC = 5.0 CO = 0.04
3. CC = 1.9 CO = 1.6
4. CC = 2.0 CO = 0.25
5. CC = 2.0 CO = 0.5
Ответ: 5
Правильно!
Вопрос:
Скорость какой из реакций выразится уравнением v = k[O2]?
1. 2SO2 + O2 => 2SO3
2. 2H2O => 2H2 + O2
3. Si + O2 => SiO2
4. 2CO + O2 => 2CO2
5. N2 + O2 => 2NO
Ответ: 3
Правильно!
Вопрос:
Каким из способов можно сместить равновесие газофазной экзотермической реакции CO + H2O < => CO2 + H2 + Q в сторону образования угарного газа?
1. понижением температуры
2. снижением давления
3. повышением давления водорода
4. повышением давления
5. введением катализатора
Ответ: 3
Правильно!
Вопрос:
При некоторой температуре к моменту установления равновесия в газофазной реакции PCl5 < => PCl3 + Cl2 концентрации всех веществ оказались равными. Первоначальная концентрация пятихлористого фосфора составляла 3 моль/л. Чему равна константа равновесия реакции при данной температуре?
1. 0.09
2. 11.05
3. 1.50
4. 1.12
5. 2.15
Ответ: 3
Правильно!
Вопрос:
Температурный коэффициент скорости реакции равен 2. На сколько градусов следует изменить температуру процесса, чтобы его скорость изменилась в 128 раз?
1. 60
2. 30
3. 70
4. 50
5. 40
Ответ: 3
Правильно!
Вопрос:
При каких концентрациях (моль/л) йода (CI) и водорода (CH) скорость реакции H2 + I2 => 2HI численно равна константе скорости?
1. CH = 0.4 CI = 2.5
2. CH = 0.1 CI = 7.5
3. CH = 0.9 CI = 1.5
4. CH = 0.5 CI = 0.5
5. CH = 2.9 CI = 0.3
Ответ: 1
Правильно!
Вопрос:
Как изменится скорость реакции 2NO + O2 => 2NO2 при увеличении давления в системе в 7 раз?
1. увеличится, x7
2. увеличится, x49
3. уменьшится, x343
4. увеличится, x343
5. уменьшится, x49
Ответ: 1
Неправильно!
Вопрос:
Каким из способов можно сместить равновесие газофазной экзотермической реакции 2CO + O2 < => 2CO2 + Q в сторону образования углекислого газа?
1. повышением температуры
2. повышением давления
3. снижением давления
4. снижением парциального давления кислорода
5. понижением давления угарного газа
Ответ: 2
Правильно!
Вопрос:
К моменту установления равновесия в реакции 2CO + O2 < => 2CO2 концентрация углекислого газа оказалась равной 2 моль/л, а первоначальные концентрации кислорода и угарного газа снизились втрое. Начальная концентрация углекислого газа составляла 1 моль/л. Чему равна константа равновесия для данной системы?
1. 1.5
2. 10.5
3. 64.0
4. 115
5. 0.12
Ответ: 3
Правильно!
Вопрос:
При повышении температуры на 30℃ относительно некоторого значения t0 скорость реакции в системе возросла в 8 раз. Во сколько раз первоначальная скорость уменьшится, если температуру снизить относительно t0 на 50℃?
1. 81
2. 64
3. 32
4. 243
5. 128
Ответ: 3
Правильно!
Вопрос:
При каких концентрациях (моль/л) кислорода (CO) и оксида углерода (CC) скорость реакции 2CO + O2 => 2CO2 численно равна константе скорости?
1. CC = 0.4 CO = 2.5
2. CC = 5.0 CO = 0.04
3. CC = 1.9 CO = 1.6
4. CC = 1.0 CO = 0.25
5. CC = 2.0 CO = 0.5
Ответ: 2
Правильно!
Вопрос:
Константа скорости реакции H2 + I2 = 2HI при определенной температуре равна 0, 1. Исходные концентрации были (моль/л) [H2] = 0, 02; [I2] = 0, 05. Как изменится скорость реакции к моменту времени, когда [H2] стала 0, 01 моль/л.
1. увеличится, x2
2. увеличится, x16
3. уменьшится, x2, 5
4. увеличится, x32
5. уменьшится, x16
Ответ: 3
Правильно!
Вопрос:
Каким из способов можно сместить равновесие газофазной экзотермической реакции 4HCl + O2 < => 2H2O + 2Cl2 + Q в сторону образования хлора?
1. повышением температуры
2. снижением давления
3. добавлением в систему водяного пара
4. повышением давления
5. введением катализатора
Ответ: 5
Неправильно!
Вопрос:
К моменту установления равновесия в газофазной реакции H2 + I2 < => 2HI концентрация йодоводорода оказалась равной 1.4 моль/л. Во сколько раз снизились первоначально равные концентрации йода и водорода, если константа равновесия K = 0.49?
1. 1.5
2. 2.5
3. 10
4. 1.35
5. 2.9
Ответ: 4
Правильно!
Вопрос:
Температурный коэффициент скорости реакции равен 3. На сколько градусов следует изменить температуру процесса, чтобы его скорость изменилась в 243 раза?
1. 81
2. 25
3. 40
4. 30
5. 50
Ответ: 5
Правильно!
Вопрос:
При каких концентрациях (моль/л) паров воды (CW) и угарного газа (CC) скорость реакции CO + H2O => CO2 + H2 численно равна константе скорости?
1. CW = 0.43 CC = 1.47
2. CW = 5.0 CC = 0.022
3. CW = 0.4 CC = 2.57
4. CW = 8.0 CC = 0.125
5. CW = 3.9 CC = 0.37
Ответ: 4
Правильно!
Вопрос:
Как изменится скорость прямой реакции в системе O2(г) + 4HCl(г) → 2H2O(г) + 2Cl2(г) если объем смеси уменьшить в 2 раза.
1. увеличится, x4
2. увеличится, x16
3. уменьшится, x32
4. увеличится, x32
5. уменьшится, x16.
Ответ: 3
Неправильно!
Вопрос:
Какое из выражений отвечает константе равновесия реакции 2FeO(T) + CO < => 2Fe(T) + CO2?
1. 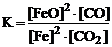
2. 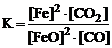
3. 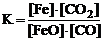
4. 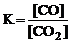
5. 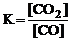
Ответ: 5
Правильно!
Вопрос:
Исходные концентрации азота и водорода в реакции N2 + 3H2 < => 2NH3 равны 3 и 5.6 моль/л соответственно. К моменту достижения равновесия в реакцию вступило 30% исходного азота. Чему равна константа равновесия?
1. 0.06326
2. 0.0071
3. 0.543
4. 1.2852
5. 0.00121
Ответ: 1
Правильно!
Вопрос:
При повышении температуры на 30℃ относительно некоторого значения t0 скорость реакции в системе возросла в 8 раз. Во сколько раз первоначальная скорость уменьшится, если температуру снизить относительно t0 на 50℃?
1. 81
2. 64
3. 32
4. 243
5. 128
Ответ: 3
Правильно!
|
|