
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Домашние задания. Термохимия
|
|
| Вариант | ||||||||||||||
| Номера вопросов | ||||||||||||||
КИНЕТИКА
Скорость химических реакций
И химическое равновесие
Скорость химических реакций, влияние на нее концентрации реагирующих веществ и температуры. Катализ. Необратимые и обратимые реакции. Константа химического равновесия. Правило Ле Шателье. Смещение химического равновесия.
Химическая кинетика – это учение о скоростях химических реакций и механизмах их протекания.
Системой в химии называется часть пространства, заполненная веществом и отграниченная от окружающей среды воображаемой или реальной поверхностью раздела. Система состоит из одной или нескольких фаз. Фазой называется совокупность всех однородных частей системы, обладающих одинаковым химическим составом и свойствами и отделенных от остальных частей системы поверхностью раздела, при переходе через которую свойства системы изменяются скачком. Системы, состоящие из одной фазы, являются гомогенными (смесь газов, растворы), двух или более фаз – гетерогенными (вода жидкая + лед, кристаллы + раствор).
Скорость химических реакций в гомогенных системах равна изменению молярной концентрации одного из веществ, участвующих в процессе, за единицу времени.
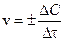 (моль/л× с).
(моль/л× с).
Скорость химической реакции зависит от природы реагирующих веществ, их концентраций, от температуры и присутствия катализатора.
Влияние концентрации реагирующих веществ на скорость химической реакции.
Химическое взаимодействие веществ в газообразной среде или в растворе происходит при столкновении молекул этих веществ. Число успешных столкновений при постоянной температуре зависит от действующей массы вещества, которая пропорциональна общему количеству молекул в единице объема или числу молей вещества в единице объема, т.е. молярной концентрации. Зависимость скорости химической реакции от концентрации определяется законом действующих масс: скорость химической реакции пропорциональна произведению молярных концентраций реагирующих веществ, взятых в степенях, соответствующих коэффициентам для этих веществ в уравнении химической реакции. Если уравнение реакции имеет вид
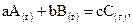
то для этой реакции выражение скорости определяется уравнением
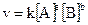 ,
,
где v - скорость реакции; a и b – стехиометрические коэффициенты в уравнении реакции; k – константа скорости; [A] и [B] – молярные концентрации веществ A и B соответственно.
Константа скорости есть скорость химической реакции при концентрациях исходных веществ, равных 1 моль/л; она зависит от природы реагирующих веществ, от температуры и от присутствия катализатора и не зависит от концентрации (давления).
Влияние температуры на скорость химической реакции. Зависимость скорости реакции от температуры приближенно может быть выражена правилом Вант-Гоффа, согласно которому при увеличении температуры на каждые 10 градусов скорость химической реакции возрастает в 2-4 раза. Если известна скорость химической реакции v1 при температуре T1, то скорость этой реакции при температуре T2 может быть вычислена по формуле
 ,
,
где g - температурный коэффициент скорости химической реакции, равный 2-4.
Скорость реакции в гетерогенных системах.
Закономерности, определяющие течение реакций в гомогенных системах, распространяются на гетерогенные системы не в полной мере. Например, в гетерогенной системе газ - твердое тело столкновение между молекулами газа и твердого вещества может происходить лишь на поверхности раздела фаз, таким образом концентрация твердого вещества в целом (масса твердой фазы) не влияет на скорость реакции. При восстановлении оксида железа (II) водородом
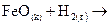
скорость реакции не зависит от концентрации FeO и пропорциональна только концентрации водорода, т.е.  .
.
Гетерогенная реакция протекает на поверхности раздела фаз, поэтому, чем больше поверхность соприкосновения, тем выше скорость реакции. Вот почему твердые вещества значительно быстрее реагируют в измельченном состоянии.
Катализ. Катализом называется изменение скорости химической реакции под влиянием присутствующего в реагирующей системе постороннего вещества, состав и количество которого к концу реакции остаются без изменения. При гомогенном катализе взаимодействующие вещества и катализатор составляют однофазную систему (например, взаимодействие газов NH3 и HCl в присутствии паров H2O). При гетерогенном катализе реагирующие вещества и катализатор находятся в разных фазах (например, воспламенение смеси водорода и кислорода на поверхности твердого вещества – платиновой черни). Явление катализа широко используется в химической промышленности.
Химическое равновесие. Все химические реакции можно разделить на два типа: необратимые и обратимые. Обратимыми называются реакции, протекающие одновременно в двух противоположных направлениях; необратимыми – реакции, протекающие практически до конца в одном направлении. Число необратимых реакций ограничено; большинство реакций обратимы.
Для обратимой химической реакции
aA + bB D mM + nN,
протекающей в гомогенной системе, скорости прямого (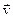 ) и обратного (
) и обратного ( ) процессов определяются уравнениями:
) процессов определяются уравнениями:
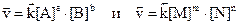 .
.
При этом скорость прямой реакции (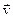 ) уменьшается, а скорость обратной реакции (
) уменьшается, а скорость обратной реакции ( ) увеличивается.
) увеличивается.
В момент установления равновесия прямая и обратная реакции не прекращаются, а продолжают протекать в противоположных направлениях с равными скоростями, т.е. 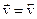 . Тогда
. Тогда
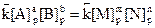
и соотношение между концентрациями реагирующих веществ имеет вид
 ,
,
где K - константа равновесия (величина постоянная для данной температуры); [A]p, [B]p, [M]p и [N]p – равновесные молярные концентрации веществ A, B, M, и N; a, b, m, n – стехиометрические коэффициенты.
Константой равновесия называется отношение констант скоростей прямой и обратной реакций при постоянной температуре. Её величина может быть рассчитана как отношение произведения равновесных концентраций продуктов реакции, взятых в степенях, равных стехиометрическим коэффициентам, к произведению равновесных концентраций исходных веществ, также взятых в степенях, равных стехиометрическим коэффициентам.
Константа равновесия зависит от природы реагирующих веществ и температуры и не зависит от концентрации реагирующих веществ.
Для равновесной системы, если реакция протекает в гетерогенных условиях, например
СaCO3(к) D СaO(к) + CO2(г),
выражение константы равновесия будет иметь вид K=[CO2]p, так как концентрации твердых веществ (CaCO3 и CaO), определяемые числом молей вещества в единице его объема, есть величины постоянные и в выражении K не пишутся.
Смещение химического равновесия. Положению равновесия системы реагирующих веществ соответствует такое её состояние, при котором скорости прямой и обратной реакций равны. При изменении внешних условий происходит изменение положения равновесия, так называемое смещение равновесия. Если равновесие смещается вправо, это означает, что в равновесной системе увеличиваются концентрации продуктов, если влево – концентрации исходных веществ. Направление смещения равновесия системы при изменении концентрации, температуры или давления определяется принципомЛе Шателье. Если на систему, находящуюся в равновесии, воздействовать извне, изменяя условия, определяющие положение равновесия, то оно сместится в таком направлении, что оказанное воздействие уменьшится.
Влияние различных факторов на положение химического равновесия рассмотрим на примере равновесной системы
N2(г) + 3H2(г) D 2NH3(г); DHх.р.< 0,
в которой прямая реакция протекает с выделением тепла.
В каком направлении будет смещаться равновесие в этой системе при увеличении давления и понижении температуры? Согласно принципу Ле Шателье, повышение давления смещает равновесие в направлении понижения давления т.е. в сторону химической реакции, идущей с уменьшением числа молей газообразных веществ. Объем исходных газов (N2 + 3H2) в два раза больше объема продукта 2NH3. Поэтому при увеличении давления в системе произойдет смещение равновесия в сторону прямой реакции, т.е. слева направо. Повышение температуры вызывает смещение равновесия в сторону химической реакции, протекающей с поглощением тепла, а понижение температуры - в сторону химической реакции, идущей с выделением тепла, т.е. слева направо.
Смещение равновесия происходит также при изменении концентрации реагирующих веществ. Повышение концентрации какого-либо реагента смещает равновесие в сторону химической реакции, ведущей к уменьшению концентрации этого реагента.
Поэтому для получения максимального выхода аммиака в данной реакции надо увеличить концентрации азота или водорода или уменьшить концентрацию конечного продукта – аммиака.
|
|