
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Примеры решения задач. Пример 1. Как изменится скорость реакции
|
|
Пример 1. Как изменится скорость реакции
2H2 + O2 ®,
если давление увеличить в три раза?
Решение. По закону действующих масс скорость реакции
v=k[H2]2[O2].
Если давление увеличить в три раза, то и концентрации H2 и O2 увеличатся во столько же раз. Скорость реакции в новых условиях будет
v’=k× (3[H2])2× (3[O2])=27k[H2]2[O2],
т.е. увеличится в 27 раз.
Пример 2. Во сколько раз увеличится скорость реакции при повышении температуры от 10 до 100°С, если коэффициент g равен двум?
Решение. По правилу Вант-Гоффа
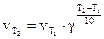 , отсюда
, отсюда
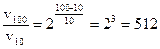 раз.
раз.
Пример 3. Реакция протекает по уравнению
N2 + 3H2 D 2NH3.
Определить исходные концентрации веществ N2 и H2, если равновесные концентрации составляли (моль/л):
[N2]=0, 2; [H2]=0, 3 и [NH3]=0, 25.
Решение 1-й способ
Из условия задачи следует, что в исходной смеси аммиака не было, т.е. его концентрация была равна нулю.
Согласно уравнению реакции для образования 2 моль аммиака расходуются 1 моль азота и 3 моль водорода. Тогда для получения 0, 25 моль NH3 потребуется 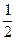 × 0, 25=0, 125 моль и
× 0, 25=0, 125 моль и 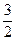 × 0, 25=0, 375 моль H2.
× 0, 25=0, 375 моль H2.
Отсюда исходные концентрации N2 и H2 будут равны (моль/л):
[N2]исх=0, 125+0, 2=0, 325
[H2]исх=0, 375=0, 3=0, 675
|
|